Менопур
Состав
Менопур 600 МЕ:
действующее вещество: менотропин высокоочищенный;
1 флакон с порошком содержит менотропин высокоочищенный (человеческий менопаузный гонадотропин высокоочищенный, чМГ) в количестве, соответствующем 600 МЕ ФСГ (фолликулостимулирующий гормон) и 600 МЕ ЛГ (лютеинизирующий гормон).
Менопур 1200 МЕ:
действующее вещество: менотропин высокоочищенный;
1 флакон с порошком содержит менотропин высокоочищенный (человеческий менопаузный гонадотропин высокоочищенный, чМГ) в количестве, соответствующем 1200 МЕ ФСГ (фолликулостимулирующий гормон) и 1200 МЕ ЛГ (лютеинизирующий гормон).
вспомогательные вещества: лактоза, моногидрат; натрия гидрофосфат, гептагидрат; полисорбат 20; 1 М раствор кислоты фосфорной;
1 шприц с растворителем содержит м-крезол, вода для инъекций.
Лекарственная форма
Порошок лиофилизированный для раствора для инъекций.Основные физико-химические свойства:
порошок: белый или почти белый лиофилизат в виде коржа;
растворитель: прозрачный, бесцветный раствор.
Фармакологическая группа. Гонадотропины и другие стимуляторы овуляции. Человеческий менопаузный гонадотропин. Код АТХ G03G A02.
Фармакологические свойства
Фармакодинамика.
В препарате Менопур присутствует человеческий хорионический гонадотропин (чХГ) – природный гормон, содержащийся в моче постменопаузных женщин, который преимущественно обеспечивает активность ЛГ.
Менотропин, имеющий активность ФСГ и ЛГ, индуцирует фолликулярный рост и развитие, а также гонадную секрецию стероидов у женщин, не страдающих первичной недостаточностью яичников. Сначала ФСГ запускает восстановление фолликулярного роста на стадии раннего фолликулогенеза, тогда как ЛГ важен для овариального стероидогенеза и участвует в физиологических процессах, приводящих к развитию соответствующего предовуляторного фолликула. Фолликулярный рост можно стимулировать ФСГ при полном отсутствии ЛГ, но полученные фолликулы развиваются аномально. Кроме того, такая стимуляция сопровождается низкими уровнями эстрадиола, что приводит к недостаточной лютеинизации.
В соответствии с действием ЛГ, направленным на повышение стероидогенеза, в циклах IVF/ICSI с десенсибилизацией, уровни эстрадиола при лечении Менопуром выше, чем при применении рекомбинантных препаратов ФСГ. Это следует учитывать, если контроль реакции пациенток проводят путем определения уровней эстрадиола. Различий в достигнутых уровнях эстрадиола не было установлено при использовании низкодозовых протоколов индукции овуляции у пациенток с ановуляцией.
Фармакокинетика.
Был исследован фармакокинетический профиль ФСГ препарата Менопур. После 7-дневного введения 150 МЕ Менопура здоровым женщинам-добровольцам с десенсибилизированным гипофизом максимальные плазменные концентрации ФСГ (откорректированы в соответствии с базовыми) (среднее ± СО) для подкожного и внутримышечного введения составляли 8,9 ± 3,5 МЕ/л и 8,9 ± 3,5 МЕ/л соответственно. Максимальные концентрации ФСГ достигаются в течение 7 часов для обоих путей введения. После повторного введения период полувыведения ФСГ составляет 30 ± 11 часов и 27 ± 9 часов для подкожного и внутримышечного введения соответственно (среднее ± СО). Хотя индивидуальные концентрации ЛГ в зависимости от времени растут после введения Менопура, имеющихся данных недостаточно для проведения фармакокинетического анализа.
Менотропин выводится, прежде всего, почками.
Фармакокинетика Менопура у пациенток с нарушением почечной или печеночной функции не изучалась.
Клинические характеристики
Показания
Лечение бесплодия при следующих клинических показаниях:
• ановуляция, включая синдром поликистозных яичников (СПКЯ), у женщин, которые оказались нечувствительными к лечению кломифена цитратом;
• контролируемая овариальная гиперстимуляция с целью индукции развития множественных фолликулов в рамках проведения вспомогательных репродуктивных технологий (ВРТ) (например оплодотворения in vitro/перенос эмбриона (IVF/ET), трансфер гаметы в фаллопиевую трубу (GIFT) и внутрицитоплазматическое введение спермы (ICSI);
• стимуляция фолликулярного роста у женщин с гипогонадотропным гипогонадизмом.
Противопоказания
Менопур противопоказан женщинам:- с гиперчувствительностью к действующему веществу или к любому из вспомогательных веществ препарата;
- с опухолями гипофиза или гипоталамуса;
- с карциномой яичников, матки или молочных желез;
- с гинекологическими кровотечениями неустановленной этиологии;
- с преждевременной менопаузой;
- с кистами яичников или с увеличенными яичниками, что не связано с синдромом поликистозных яичников (СПКЯ);
- в период беременности и кормления грудью.
Менопур не следует назначать в случаях, когда маловероятно, что результат лечения будет благоприятным:
- при первичной недостаточности яичников;
- при врожденных пороках развития половых органов, несовместимых с беременностью;
- при фиброидных опухолях матки, несовместимых с беременностью.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий.
Медикаментозное взаимодействие Менопура у человека не изучалось. Даже при отсутствии клинического опыта ожидается, что одновременное применение Менопура и кломифена цитрата может усилить фолликулярную реакцию. При применении агонистов ГнРГ для десенсибилизации гипофиза для достижения надлежащей фолликулярной реакции могут потребоваться более высокие дозы Менопура.
Особенности применения
Поскольку Менопур имеет сильную гонадотропную активность, которая может повлечь побочные эффекты от легкой до средней степени тяжести, препарат следует применять под контролем врачей, специализирующихся на лечении бесплодия и имеющих опыт такого лечения.Лечение гонадотропинами требует тщательного медицинского наблюдения, а также регулярного мониторинга реакции яичников, а именно: ультразвуковых обследований, возможно, в сочетании с определением сывороточных уровней эстрадиола. Реакция на введение менотропина у пациенток существенно отличается, причем некоторые из них очень слабо реагируют на лечение. Следует применять самую низкую эффективную дозу препарата, которая соответствует цели лечения.
Первую инъекцию Менопура следует проводить под непосредственным наблюдением врача.
До начала лечения следует подтвердить у супругов диагноз бесплодия и установить возможные противопоказания к беременности. В частности, пациенток необходимо обследовать на наличие гипотиреоза, недостаточности коры надпочечников, гиперпролактинемии и опухолей гипофиза или гипоталамуса, после чего в случае необходимости назначить им соответствующее лечение.
У пациенток, которым в рамках лечения ановулярного бесплодия или проведения ВРТ проводят стимуляцию фолликулярного роста, возможно увеличение яичников или их гиперстимуляция. Такие случаи можно минимизировать, если строго придерживаться рекомендуемых доз и режима введения препарата, а также осуществлять тщательный мониторинг терапии.
Точную оценку фолликулярного развития и созревания должен проводить врач, имеющий опыт интерпретации соответствующих тестов.
Синдром гиперстимуляции яичников (СГСЯ).
СГСЯ представляет собой клиническое явление, которое отличается от неосложненного увеличения яичников. СГСЯ – это синдром, который проявляется с увеличением степени тяжести. Признаки СГСЯ включают увеличение яичников, высокие сывороточные уровни половых гормонов и увеличение проницаемости сосудов, что может приводить к накоплению жидкости в перитонеальной, плевральной и в редких случаях – в перикардиальной полостях.
Тяжелые случаи СГСЯ могут сопровождаться следующими симптомами: абдоминальная боль, абдоминальное растяжение, чрезмерное увеличение яичников, увеличение массы тела, одышка, олигурия и желудочно-кишечные симптомы, такие как тошнота, рвота и диарея. При клиническом обследовании могут быть выявлены гиповолемия, сгущение крови, нарушение баланса электролитов, асцит, гемоперитонеум, плевральный выпот, гидроторакс, острая дыхательная недостаточность и тромбоэмболия.
Чрезмерная овариальная реакция на лечение гонадотропинами редко приводит к развитию СГСЯ до тех пор, пока с целью инициирования овуляции не вводят чХГ. Поэтому в случае овариальной гиперстимуляции не следует вводить чХГ; нужно посоветовать пациентке воздержаться от половых контактов или использовать барьерные методы контрацепции в течение не менее 4 дней. СГСЯ может очень быстро прогрессировать (от 24 часов до нескольких дней) и приобретать серьезную симптоматику, поэтому пациентка должна находиться под медицинским контролем на протяжении не менее 2 недель после введения чХГ.
Минимизировать риск развития овариальной гиперстимуляции и многоплодной беременности можно, если придерживаться рекомендованной дозировки и режима введения препарата Менопур, а также тщательно контролировать курс лечения. При проведении ВРТ риск развития гиперстимуляции можно снизить путем аспирации всех фолликулов перед овуляцией.
СГСЯ может становиться более тяжелым и длительным при наступлении беременности. Чаще всего СГСЯ развивается после завершения гормональной терапии и достигает максимальной частоты примерно через 7-10 дней после окончания лечения. Обычно СГСЯ проходит спонтанно с началом менструации.
В случае тяжелого СГСЯ лечение гонадотропинами следует прекратить. Если оно все еще продолжается, пациентку необходимо госпитализировать и начать специфическое лечение СГСЯ.
Данный синдром чаще наблюдается у женщин с синдромом поликистозных яичников.
Многоплодные беременности.
В случае многоплодной беременности, особенно высшего порядка, повышается риск осложнений для матери и ребенка.
У пациенток, которым проводят индукцию овуляции с применением гонадотропинов, частота многоплодных беременностей выше, чем при естественном оплодотворении. Большинство случаев многоплодных беременностей представлено двойнями. Для уменьшения риска многоплодной беременности рекомендуется тщательный мониторинг овариальной реакции.
У пациенток, которым проводят процедуры ВРТ, риск многоплодной беременности главным образом зависит от количества пересаженных эмбрионов, их качества и возраста пациентки.
До начала лечения пациентку следует информировать о потенциальном риске многоплодной беременности.
Прерывание беременности.
Частота случаев прерывания беременности – преждевременных родов и спонтанных абортов – выше у пациенток, которым стимулируют фолликулярный рост в рамках проведения процедур ВРТ, чем в обычной группе пациентов.
Внематочная беременность.
У женщин с заболеваниями маточных труб в анамнезе существует риск внематочной беременности независимо от того, наступила беременность вследствие спонтанного оплодотворения или лечения бесплодия. Сообщалось, что после проведения IVF частота случаев внематочной беременности составляет 2 – 5% по сравнению с 1 – 1,5% случаев для общей группы пациентов.
Новообразования органов репродуктивной системы.
Сообщалось о случаях развития доброкачественных и злокачественных новообразований яичников и других органов репродуктивной системы у женщин, которым для лечения бесплодия применяли несколько лекарственных препаратов. До настоящего времени не установлено, повышает ли лечение с применением гонадотропинов базовый риск развития таких опухолей у бесплодных женщин.
Врожденные пороки развития.
Распространенность врожденных пороков развития после проведения ВРТ может быть немного выше, чем при спонтанном оплодотворении. Считают, что это является результатом различий характеристик родителей (например, возраст матери, характеристики спермы) и многоплодных беременностей.
Тромбоэмболические осложнения.
У женщин с общепризнанными факторами риска развития тромбоэмболических осложнений, такими как тромбоэмболическая патология в анамнезе или семейные случаи этой патологии, тяжелая степень ожирения (индекс массы тела >30 кг/м2) или тромбофилия, повышен риск венозной или артериальной тромбоэмболии во время или после завершения лечения с применением гонадотропинов. У таких женщин следует сопоставить пользу применения гонадотропинов с возможным риском. Однако следует отметить, что сама беременность тоже является фактором риска тромбоэмболических осложнений.
Применение в период беременности или кормления грудью.
Менопур противопоказан беременным женщинам.
Данных о применении менотропина беременным женщинам нет или они ограничены. Исследования на животных относительно действия Менопура во время беременности не проводились.
Менопур противопоказан женщинам, кормящим грудью.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Соответствующие исследования не проводились. Однако маловероятно, что Менопур может влиять на способность пациенток управлять автомобилем или выполнять работу, требующую повышенного внимания и быстрой реакции.
Способ применения и дозы
Лечение с применением Менопура следует начинать под наблюдением врача, имеющего опыт лечения бесплодия.
Менопур 600 МЕ и Менопур 1200 МЕ предназначены для подкожной инъекции после восстановления растворителем, поскольку шприц, который содержится в упаковке, предназначен только для подкожного введения.
Порошок необходимо растворить перед применением. Приготовленный раствор предназначен для многократного применения и может храниться в течение 28 дней.
При растворении следует избегать интенсивного встряхивания. Раствор нельзя использовать, если он непрозрачный или содержит частицы.
Режимы дозирования, описанные ниже, аналогичны как при подкожном, так и при внутримышечном введении. Менопур 600 МЕ и Менопур 1200 МЕ можно вводить только подкожно, поскольку шприц, который содержится в упаковке, предназначен только для подкожного введения.
Реакция яичников на введение экзогенных гонадотропинов является индивидуальной. Это приводит к тому, что невозможно установить одну универсальную схему дозирования. Поэтому дозировку препарата следует подбирать индивидуально, согласно овариальному ответу. Менопур можно применять в виде монотерапии или в составе комбинированной терапии совместно с агонистом или антагонистом гонадотропин-рилизинг-гормона (Гн-РГ). Рекомендуемые дозы и длительность лечения зависят от применяемого протокола лечения.
Женщины с ановуляцией (включая СПКЯ).
Целью терапии с применением Менопура является развитие одного граафова фолликула, из которого после введения человеческого хорионического гонадотропина (чХГ) высвобождается ооцит.
Терапию с применением Менопура следует начинать в течение первых 7 дней менструального цикла. Рекомендуемая ежедневная начальная доза Менопура составляет от 75 до 150 МЕ, которую следует поддерживать в течение не менее 7 дней. Дальнейший режим лечения следует подбирать индивидуально, в соответствии с реакцией яичников и на основании результатов клинического контроля (который включает ультразвуковые исследования, возможно, в сочетании с определением уровня эстрадиола).
Дозу препарата не следует менять чаще, чем через 7 дней. Рекомендуемое пошаговое увеличение дозы составляет 37,5 МЕ, при этом оно не должно превышать 75 МЕ. Максимальная суточная доза не должна превышать 225 МЕ. В случае ненадлежащей реакции пациентки после 4 недель лечения терапевтический цикл следует прекратить и начать новый цикл с более высокой дозы препарата по сравнению с той, которая применялась в предыдущем цикле.
При достижении оптимальной реакции через 1 день после последней инъекции Менопура следует сделать разовую инъекцию чХГ в дозе от 5000 до 10000 МЕ.
Пациентке рекомендуется иметь половой контакт в день введения чХГ и на следующий день.
Альтернативно может быть проведено внутриматочное оплодотворение (IUI). При чрезмерной реакции на применение Менопура курс лечения следует прекратить и отменить введение чХГ (см. раздел «Особенности применения»). Пациентка должна использовать барьерный метод контрацепции или отказаться от половых контактов до начала следующего менструального кровотечения.
Женщины, у которых проводят контролируемую овариальную гиперстимуляцию с целью индукции развития множественных фолликулов в рамках проведения вспомогательных репродуктивных технологий (ВРТ).
Согласно результатам клинических испытаний применения Менопура, предусматривающих десенсибилизацию с применением агониста ГнРГ, терапию Менопуром следует начинать приблизительно через 2 недели после начала лечения агонистом. На протяжении не менее 5 первых дней лечения рекомендуется вводить Менопур в суточной дозе от 150 до 225 МЕ.
Согласно результатам клинического контроля (который включает ультразвуковые исследования, возможно, в сочетании с определением уровней эстрадиола), в дальнейшем дозу следует подбирать индивидуально, в соответствии с реакцией пациентки, при этом шаг увеличения дозы не должен превышать 150 МЕ. Максимальная суточная доза не должна превышать 450 МЕ. В большинстве случаев не рекомендуется продолжать лечение более 20 дней.
При использовании протоколов, которые не предусматривают десенсибилизации с применением агонистов ГнРГ, терапию с применением Менопура следует начинать на 2-й или 3-й день менструального цикла. Рекомендуется использовать такие же дозы и схему введения, что и для протоколов, предусматривающих десенсибилизацию с применением агонистов ГнРГ.
При образовании достаточного количества фолликулов соответствующего размера для индукции конечного созревания фолликулов следует сделать разовую инъекцию чХГ в дозе до 10000 МЕ.
Пациентка должна находиться под тщательным медицинским наблюдением в течение не менее 2 недель после введения чХГ. При чрезмерной реакции на применение Менопура курс лечения следует прекратить и отменить введение чХГ (см. раздел «Особенности применения»). Пациентка должна использовать барьерный метод контрацепции или отказаться от половых контактов до начала следующего менструального кровотечения.
Приготовление раствора Менопур 600 МЕ и 1200 МЕ.
Если Ваша клиника попросила Вас делать инъекции Менопура самостоятельно, Вам следует соблюдать все предоставленные ею инструкции.
Первая инъекция Менопура должна быть сделана под наблюдением врача или медсестры.
Менопур 600 МЕ:
Менопур выпускается в виде порошка во флаконе, перед инъекцией его следует растворить с помощью одного шприца, наполненного растворителем. Растворитель, который Вам следует применять для растворения Менопура, содержится в предварительно заполненном шприце в упаковке.
Менопур 600 МЕ перед применением следует растворить с помощью одного предварительно заполненного шприца с растворителем.
После растворения порошка с помощью растворителя этот флакон содержит лекарственное средство в количестве, достаточном для нескольких дней терапии, поэтому Вам следует убедиться, что Вы набираете лекарственное средство в количестве, не превышающем назначенного Вашим врачом.
Ваш врач назначил Вам дозу Менопура в МЕ (единицах). Для получения необходимой дозы Вам следует использовать один из 9 предоставленных шприцев для введения, градуированных в МЕ (единицах) ФСГ/ЛГ.
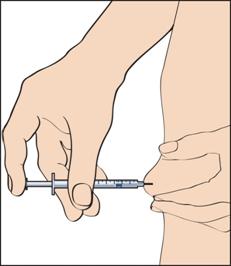
11. Чтобы сделать инъекцию, следует защипнуть кожу так, чтобы образовалась складка, и ввести иглу одним быстрым движением под углом 90 градусов к телу. Осторожно нажать на поршень, чтобы ввести раствор (рисунок 11), после чего вынуть шприц для введения.
Вынув шприц для введения, нажать на место инъекции, чтобы остановить кровотечение. Осторожный массаж места инъекции будет способствовать распространению раствора под кожей.
Не следует выбрасывать использованные предметы в бытовые отходы; их следует должным образом утилизировать.
12. Чтобы сделать следующую инъекцию уже разбавленного раствора Менопур, необходимо повторить шаги 8-11.
Если Вы приняли Менопур в количестве, большем, чем нужно,
пожалуйста, сообщите об этом медсестре или врачу.
Если Вы забыли принять Менопур,
не принимайте двойную дозу, чтобы компенсировать пропущенную. Пожалуйста, сообщите медсестре или врачу.
Общие указания
Приготовленный раствор не следует вводить, если он содержит частицы или является непрозрачным.
Любой неиспользованный в течение установленного срока годности препарат или его отходы следует утилизировать в соответствии с местными требованиями.
Дети.
Препарат не применяют детям.
Передозировка
Проявления передозировки препарата неизвестны, хотя можно ожидать развития синдрома гиперстимуляции яичников.
Побочные реакции
В клинических испытаниях Менопура чаще всего сообщалось о следующих побочных реакциях: абдоминальная боль, головная боль, реакции и боль в месте введения препарата, частота которых достигала 5%.
Ниже перечислены основные побочные реакции у женщин, которым применяли Менопур в клинических испытаниях.
Побочные реакции распределены по частоте следующим образом: очень частые (≥ 1/10), частые (≥ 1/100 до
Нарушения со стороны органов зрения: частота неизвестна – нарушение зренияa.
Нарушения со стороны желудочно-кишечного тракта: частые – абдоминальная боль, вздутие живота, тошнота; нечастые – рвота, абдоминальный дискомфорт, диарея.
Общие нарушения и нарушения в месте введения: частые – реакции в месте инъекцииb; нечастые – слабость, частота неизвестна – пирексия, недомогание.
Нарушения со стороны иммунной системы: частота неизвестна – реакции гиперчувствительностис.
Исследования: частота неизвестна – увеличение массы тела.
Нарушения со стороны костно-мышечной и соединительной ткани: частота неизвестна –скелетно-мышечная больd.
Нарушения со стороны нервной системы: частые – головная боль; нечастые – головокружение.
Нарушения со стороны половых органов и молочных желез: частые – СГСЯe, боль в области тазаf; нечастые – киста яичников, жалобы на боль в грудиg; частота неизвестна – перекрут яичникаe.
Нарушения со стороны кожи и подкожных тканей: редкие – акне, сыпь; частота неизвестна – зуд, крапивница.
Нарушения со стороны сердечно-сосудистой системы: нечастые – приливы; частота неизвестна – тромбоэмболияe.
aОтдельные случаи временного амавроза, диплопии, мидриаза, скотомы, фотопсии, плавающие помутнения стекловидного тела, помутнения зрения и расстройства зрения были зарегистрированы как нарушения зрения в постмаркетинговый период.
bНаиболее часто сообщалось о реакции в месте инъекции, а именно о боли в месте инъекции.
cИмеются сообщения о единичных случаях локализованных или генерализованных аллергических реакций, включая анафилактические реакции, наряду с соответствующей симптоматикой.
dМышечно-скелетная боль включает артралгию, боль в спине, боль в шее и боль в конечностях.
eПри применении Менопура в клинических испытаниях сообщалось о развитии желудочно-кишечных симптомов, связанных с СГСЯ, таких как вздутие живота, ощущение дискомфорта, тошнота, рвота и диарея. Случаи тяжелого асцита, связанного с СГСЯ, и накопления жидкости в тазу, плеврита, одышки, олигурии, тромбоэмболических явлений и перекрута яичников были представлены как редкие осложнения.
fТазовые проблемы включают боль в яичниках и опущение матки.
gЖалобы относительно грудных желез включают боль в груди, болезненность молочных желез, дискомфорт, боль в сосках и набухание груди.
Срок годности
3 года.После приготовления раствор можно хранить в течение максимум 28 дней при температуре не выше 25 °С.
Условия хранения
Хранить в недоступном для детей месте. Хранить в холодильнике(2-8 °С) в оригинальной упаковке. Не замораживать.
Несовместимость. Приготовленный раствор препарата Менопур не следует смешивать с другими лекарственными средствами, за исключением препарата урофоллитропина Бравель (ФСГ) производства компании Ферринг. Исследования показали, что совместное введение препаратов Бравель и Менопур существенно не влияет на ожидаемую биодоступность каждого из них.
Упаковка
Менопур 600 МЕ.
1 флакон с порошком в комплекте с 1 предварительно заполненным шприцом с растворителем по 1 мл, 1 иглой для разведения, 9 шприцами для введения и 9 спиртовыми салфетками в картонной упаковке.
Менопур 1200 МЕ.
1 флакон с порошком в комплекте с 2 предварительно заполненными шприцами с растворителем по 1 мл, 1 иглой для разведения, 18 шприцами для введения и 18 спиртовыми салфетками в картонной упаковке.
Категория отпуска
По рецепту.Производитель
Ферринг ГмбХ, Германия / Ferring GmbH, Germany.
Местонахождение производителя и его адрес места осуществления деятельности
Витланд 11, 24109 Киль, Германия / Wittland 11, 24109 Kiel, Germany.




