Энбрел ЛИО
Склад
діюча речовина: етанерцепт;
1 флакон містить 25 мг етанерцепту;
допоміжні речовини: маніт (Е421), сахароза, трометамол.
1 попередньо наповнений шприц з розчинником містить воду для ін’єкцій.
Лікарська форма. Порошок для розчину для ін’єкцій.
Основні фізико-хімічні властивості: білий ліофілізат.
Фармакотерапевтична група
Імуносупресанти, інгібітори фактора-a некрозу пухлин. Етанерцепт. Код АТХ L04AB01.Фармакологічні властивості
Фармакодинаміка.
Етанерцепт – химерний білок рецептора фактора некрозу пухлин людський та p75Fc, отриманий за технологією рекомбінантної ДНК із використанням клітин ссавців як системи експресії. Етанерцепт являє собою димер химерного білка, який отримують методом генної інженерії шляхом приєднання позаклітинного ліганд-зв'язуючого домену рецептора-2 фактора некрозу пухлини людини (TNFR2/p75) до Fс домену людського IgGl. Компонент Fс містить шарнірну ділянку, ділянки СН2 та СН3, але не містить ділянки СН1 IgGl. Етанерцепт містить 934 амінокислоти та має уявну молекулярну масу приблизно 150 кДа.
Специфічна активність етанерцепту становить 1,7 х 106 одиниць/мг.
Фактор некрозу пухлин (TNF, ФНП) – цитокін, що відіграє основну роль у розвитку запального процесу при ревматоїдному артриті. Підвищений рівень ФНП також виявляється у синовіальній оболонці та псоріатичних бляшках пацієнтів із псоріатичним артритом, а також у сироватці та синовіальній тканині пацієнтів із анкілозуючим спондилітом. Інфільтрація псоріатичної бляшки запальними клітинами, включаючи Т-клітини, призводить до підвищення рівня ФНП у місцях псоріатичного ураження порівняно з неураженими ділянками шкіри. Етанерцепт є конкурентним інгібітором зв’язування ФНП із його поверхневими клітинними рецепторами, а отже, він пригнічує біологічну активність ФНП. ФНП та лімфотоксин – прозапальні цитокіни, які зв’язуються із двома окремими клітинними поверхневими рецепторами фактора некрозу пухлин (РФНП): 55 кДа (р55) та 75 кДа (р75). Обидва РФНП існують в організмі у мембрано-зв’язаній та розчинній формах. Розчинні РФНП регулюють біологічну активність ФНП.
ФНП та лімфотоксин існують переважно у вигляді гомотримерів, а їх біологічна активність залежить від перехресного зшивання РФНП, що знаходяться на поверхні клітини. Димерні розчинні рецептори, такі як етанерцепт, мають більшу афінність до ФНП, ніж мономерні рецептори, а тому є значно потужнішими конкурентними інгібіторами зв'язування ФНП з його клітинними рецепторами. Крім того, використання області Fc імуноглобуліну як елементу зв’язування в структурі димерного рецептора подовжує період напіввиведення препарату із сироватки крові.
Значна частина патологічних змін у суглобах при ревматоїдному артриті та анкілозуючому спондиліті, а також патології шкіри при бляшковому псоріазі виникають внаслідок впливу прозапальних молекул, які є частиною системи, яку контролює ФНП. Вважається, що механізм дії етанерцепту полягає у конкурентному інгібуванні зв'язування ФНП з рецепторами ФНП на поверхні клітини. Таким чином, етанерцепт перешкоджає виникненню клітинної відповіді, опосередкованої ФНП, за рахунок біологічної інактивації ФНП. Етанерцепт також здатний модулювати біологічні відповіді, що контролюються додатковими молекулами, які передають сигнал у низхідному напрямку (наприклад, цитокіни, адгезивні молекули або протеїнази), та стимулюються або регулюються ФНП.
Клінічна ефективність та безпека.
Даний розділ містить інформацію, отриману під час проведення 4 рандомізованих подвійних сліпих плацебо-контрольованих клінічних досліджень за участю дорослих пацієнтів із ревматоїдним артритом, 1 дослідження за участю дорослих пацієнтів із псоріатичним артритом, 1 дослідження за участю дорослих пацієнтів із анкілозуючим спондилітом, 1 дослідження за участю дорослих пацієнтів із аксіальним спондилоартритом без рентгенологічного підтвердження, 4 дослідження за участю дорослих пацієнтів із бляшковим псоріазом, 3 дослідження за участю пацієнтів із ювенільним ідіопатичним артритом, 1 дослідження за участю дітей із бляшковим псоріазом.
Дорослі пацієнти з ревматоїдним артритом.
Ефективність препарату Енбрел ліо оцінювалася в рандомізованому подвійному сліпому плацебо-контрольованому дослідженні. У дослідженні брали участь 234 дорослих пацієнти з ревматоїдним артритом, у яких лікування щонайменше одним, але не більше ніж чотирма базисними протиревматичними препаратами (БПРП), було неефективним. 10 мг або 25 мг препарату Енбрел ліо або плацебо вводили підшкірно два рази на тиждень протягом шести місяців поспіль. Результати цього контрольованого дослідження були представлені як відсоток поліпшення стану при ревматоїдному артриті з використанням критеріїв відповіді на терапію, розроблених Американською колегією ревматологів (АКР).
На 3 та 6 місяці лікування відповідь АКР 20 і 50 частіше спостерігалися у пацієнтів, які отримували Енбрел ліо, порівняно із пацієнтами, які отримували плацебо (АКР 20: Енбрел ліо 62% і 59%, плацебо 23% і 11%; АКР 50: Енбрел ліо 41% і 40%, плацебо 8% та 5% на 3-му і 6-му місяці відповідно; р
Приблизно 15% учасників дослідження, які отримували Енбрел ліо, досягли відповіді АКР 70 на 3 та 6 місяці дослідження порівняно з менш ніж 5% учасників дослідження у групі плацебо. У пацієнтів, які отримували Енбрел ліо, клінічні ефекти, як правило, з’являлися протягом 1-2 тижнів від початку терапії і практично завжди виникали до 3 місяця лікування. Спостерігалася залежність доза-ефект: результати, отримані при введенні дози 10 мг, були вищі тих, що були отримані при застосуванні плацебо, і нижчі тих, що були отримані при застосуванні дози 25 мг. Енбрел ліо мав достовірно кращі результати, ніж плацебо, за всіма компонентами критерію АКР, а також за всіма іншими показниками визначення активності ревматоїдного артриту, що не увійшли до АКР критерію відповіді на терапію, наприклад ранкової скутості. Опитувальник оцінки стану здоров'я (Health Assessment Questionnaire, HAQ), який містить такі розділи, як інвалідизація, життєва енергія, психічне здоров’я, загальний стан здоров'я та стан здоров’я з урахуванням артриту, заповнювався кожні 3 місяці впродовж усього дослідження. Порівняно з контрольною групою, на 3 та 6 місяці дослідження у пацієнтів, які отримували Енбрел ліо, спостерігалося поліпшення показників в усіх розділах HAQ.
Зазвичай після припинення застосування препарату Енбрел ліо симптоми артриту з’являлися знову впродовж одного місяця. Згідно з результатами відкритих досліджень, інтенсивність відповіді на лікування препаратом Енбрел ліо після перерви тривалістю до 24 місяців була подібною тій, що спостерігалася у пацієнтів, які отримували безперервне лікування. У відкритих розширених дослідженнях, під час яких пацієнти безперервно отримували препарат Енбрел ліо, тривала стійка відповідь на лікування спостерігалася впродовж періоду до 48 місяців; досвіду довготривалого застосування препарату немає.
Ефективність препарату Енбрел ліо порівнювали з ефективністю метотрексату у рандомізованому дослідженні з активним контролем та з замаскованими радіографічними визначеннями первинної кінцевої точки, яке проводилося серед 632 дорослих пацієнтів з ревматоїдним артритом (тривалістю менше 3 років), що ніколи не отримували лікування метотрексатом. Енбрел ліо вводили підшкірно по 10 або 25 мг два рази на тиждень впродовж періоду до 24 місяців. Дозу метотрексату протягом перших 8 тижнів дослідження підвищували з 7,5 мг на тиждень до 20 мг на тиждень і продовжували вводити протягом 24 місяців. Клінічне покращення, в тому числі початок дії, при застосуванні 25 мг препарату Енбрел ліо протягом 2 тижнів, було подібним до того, що спостерігалося у попередніх дослідженнях, і зберігалося протягом 24 місяців. Перед початком дослідження пацієнти мали помірний ступінь інвалідизації із середнім показником суми балів за опитувальником HAQ від 1,4 до 1,5. Лікування препаратом Енбрел ліо у дозі 25 мг призвело до значного поліпшення стану через 12 місяців, при цьому майже 44% пацієнтів досягли нормальних показників за опитувальником HAQ (менше 0,5). Отриманий ефект від лікування зберігався і на другий рік цього дослідження.
У цьому дослідженні структурне ушкодження суглобів оцінювалося рентгенологічно і виражалося як зміна загального показника Шарпа (Total Sharp Score (TSS)) та його компонентів: показника ерозивного ураження у балах та звуження суглобової щілини (JSN). Рентгенограми руки/зап'ястка і стопи були отримані перед початком дослідження та через 6, 12 і 24 місяці. Енбрел ліо у дозі 10 мг завжди демонстрував менш виражений вплив на структурне ушкодження суглобів, ніж у дозі 25 мг. Енбрел ліо у дозі 25 мг мав достовірну перевагу перед метотрексатом з точки зору показника ерозивного ураження через 12 та 24 місяці. Відмінності у показниках TSS і JSN при застосуванні метотрексату і препарату Енбрел ліо 25 мг не були статистично достовірними. Результати цього дослідження представлені на рисунку 1.
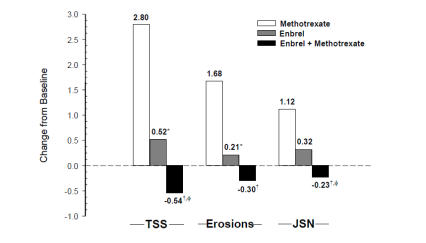
Значення р при попарному порівнянні: * = p
Рис. 2. Рентгенологічні зміни: порівняння препарату Енбрел ліо з метотрексатом та з комбінацією препарату Енбрел ліо з метотрексатом у пацієнтів, хворих на ревматоїдний артрит від 6 місяців до 20 років (результати за 12 місяців)
Достовірна перевага застосування комбінації препарату Енбрел ліо з метотрексатом порівняно з монотерапією метотрексатом та монотерапією препаратом Енбрел ліо також спостерігалася і по закінченні 24 місяців лікування. Аналогічно по закінченні 24 місяців спостерігалася достовірна перевага монотерапії препаратом Енбрел ліо порівняно з монотерапією метотрексатом.
Під час аналізу, в якому всі пацієнти, що вибули з дослідження з будь-якої причини, вважалися такими, які мали прогрес, відсоток пацієнтів без прогресу (зміни показника TSS ≤ 0,5) на 24 місяці був вищим в групі пацієнтів, що отримували Енбрел ліо в комбінації з метотрексатом порівняно з групами пацієнтів, що отримували монотерапію препаратом Енбрел ліо та метотрексатом (62%, 50% і 36% відповідно, р
Безпеку та ефективність препарату Енбрел ліо у дозі 50 мг (2 підшкірні ін’єкції по 25 мг), що застосовується 1 раз на тиждень, оцінювали у подвійному сліпому плацебо-контрольованому дослідженні за участю 420 пацієнтів з активним ревматоїдним артритом. У цьому дослідженні 53 пацієнти отримували плацебо, 214 пацієнтів отримували Енбрел ліо у дозі 50 мг 1 раз на тиждень і 153 пацієнти отримували Енбрел ліо у дозі 25 мг 2 рази на тиждень. На 8 тижні лікування профілі безпеки та ефективності двох режимів терапії препаратом Енбрел ліо були зіставними з точки зору їх впливу на симптоматику ревматоїдного артриту; проте дані, отримані на 16 тижні, не продемонстрували зіставлення (відсутність переваг) цих двох режимів терапії.
Дорослі пацієнти з псоріатичним артритом.
Ефективність препарату Енбрел ліо оцінювалася в одному рандомізованому подвійному сліпому плацебо-контрольованому дослідженні із залученням 205 пацієнтів із псоріатичним артритом. Усі пацієнти були віком від 18 до 70 років і мали активний псоріатичний артрит (≥ 3 набряклих суглобів і ≥ 3 болісних суглобів) принаймні однієї з таких форм: артрит з ураженням дистальних міжфалангових суглобів (1), поліартикулярний артрит (відсутність ревматоїдних вузлів та наявність псоріазу) (2), мутилюючий артрит (3); асиметричний псоріатичний артрит (4); спондилітоподібний анкілоз (5). Також пацієнти мали бляшковий псоріаз (для включення пацієнта у дослідження діаметр бляшки мав становити більше
Клінічні відповіді були виражені у відсотках пацієнтів, які досягли показника АКР 20, 50 і 70, і відсотках пацієнтів, у яких спостерігалося покращення стану згідно із критеріями відповіді на лікування при псоріатичному артриті (PsARC). Узагальнені результати наведено у таблиці 2.
Таблиця 2
Відповіді на лікування у пацієнтів з псоріатичним артритом, отримані у плацебо-контрольованому дослідженні
У пацієнтів з псоріатичним артритом, які отримували Енбрел ліо, клінічна відповідь була очевидною вже під час першого візиту (через 4 тижні) та зберігалася впродовж 6 місяців лікування. Енбрел ліо за всіма показниками, що характеризують активність захворювання, був достовірно кращим ніж плацебо (р
Оцінка рентгенологічних змін проводилася під час дослідження серед пацієнтів із псоріатичним артритом. Рентгенограми руки/зап'ястка і стопи були отримані перед початком дослідження та через 6, 12 і 24 місяці. Модифіковані показники TSS через 12 місяців представлені у таблиці 3. Під час аналізу, у якому всі пацієнти, що вибули з дослідження з будь-якої причини, вважалися такими, які мали прогрес, відсоток пацієнтів без прогресу (зміни показника TSS ≤ 0,5) на 12 місяці був вищим в ,групі пацієнтів, що отримували Енбрел ліо порівняно з групою пацієнтів, що отримували плацебо (73 % проти 47% відповідно, р ≤ 0,001). Позитивний вплив препарату Енбрел ліо на динаміку рентгенологічних змін зберігався у пацієнтів, які продовжували лікування протягом другого року. У пацієнтів з симетричним поліартикулярним ураженням суглобів спостерігалося уповільнення динаміки ушкодження периферичних суглобів.
Таблиця 3
Середня (СП) щорічна зміна загального показника Шарпа порівняно з вихідним рівнем
Терапія препаратом Енбрел ліо протягом подвійного сліпого періоду дослідження призвела до поліпшення функціональної активності, і такий результат лікування зберігався під час більш довгострокової фази дослідження, яка тривала до 2 років.
Даних, які б підтверджували ефективність препарату Енбрел ліо для пацієнтів з такими псоріатичними артропатіями як артрит по типу анкілозуючого спондиліту та мутилюючого артриту, недостатньо через невелику кількість пацієнтів, що брали участь у дослідженнях.
Дослідження режиму дозування 50 мг 1 раз на тиждень за участю пацієнтів із псоріатичним артритом не проводилися. Дані, які свідчать про ефективність введення препарату 1 раз на тиждень для цієї групи пацієнтів, ґрунтуються на результатах дослідження, проведеного за участю пацієнтів із анкілозуючим спондилітом.
Дорослі пацієнти з анкілозуючим спондилітом.
Ефективність препарату Енбрел ліо для пацієнтів з анкілозуючим спондилітом була оцінена у 3 рандомізованих подвійних сліпих дослідженнях, в ході яких порівнювали застосовування 25 мг препарату Енбрел ліо два рази на тиждень та плацебо. У ці дослідження було залучено 401 пацієнта, з яких 203 пацієнти отримували Енбрел ліо. У наймасштабніше з цих досліджень (n = 277) були включені пацієнти віком від 18 до 70 років з активним анкілозуючим спондилітом, ознаками якого були: більше 30 балів для показників середньої тривалості захворювання та ступеня ранкової скутості за візуальною аналоговою шкалою (ВАШ), а також більше 30 балів (за шкалою ВАШ) принаймні для 2 з 3 таких параметрів: загальна оцінка стану пацієнта, середні значення за шкалою ВАШ інтенсивності нічного болю у спині та загального показника болю у спині, середнє значення за результатами 10 відповідей на питання, які визначають функціональний індекс при анкілозуючому спондиліті (Bath Ankylosing Spondylitis Functional Index (BASFI)). Пацієнти, які отримували БПРП, НПЗЗ або кортикостероїди, могли продовжувати приймати їх у стабільній дозі. Пацієнти з повним анкілозом хребта не були включені у це дослідження. Енбрел ліо у дозі 25 мг (визначеній за результатами досліджень щодо встановлення оптимальної дози для пацієнтів з ревматоїдним артритом) або плацебо вводили підшкірно два рази на тиждень протягом 6 місяців 138 пацієнтам.
Основним критерієм ефективності (ASAS 20) було покращення на ≥ 20% принаймні у 3 з 4 категорій Оцінки анкілозуючого спондиліту (Аssessment in ankylosing spondylitis (ASAS)) (загальна оцінка стану пацієнта, інтенсивність болю у спині, BASFI та запалення) і відсутність погіршення у тій категорії, що залишилася. У показниках ASAS 50 і 70 використовувалися ті ж критерії, але покращення мало бути 50% або 70% відповідно. Порівняно з плацебо лікування препаратом Енбрел ліо призвело до достовірного поліпшення показників ASAS 20, ASAS 50 і ASAS 70 вже через 2 тижні після початку терапії.
Таблиця 4
Відповіді на лікування пацієнтів з анкілозуючим спондилітом, отримані у плацебо-контрольованому дослідженні
У пацієнтів з анкілозуючим спондилітом, які отримували Енбрел ліо, клінічна відповідь була очевидною вже під час першого візиту (через 2 тижні) та зберігалася впродовж 6 місяців лікування. Відповіді на лікування були аналогічними у пацієнтів, які отримували або не отримували супутню терапію на момент початку дослідження.
Аналогічні результати були отримані в 2 невеликих дослідженнях у пацієнтів з анкілозуючим спондилітом.
У четвертому подвійно сліпому плацебо-контрольованому дослідженні за участю 356 пацієнтів з активним анкілозуючим спондилітом оцінювали безпеку та ефективність
препарату Енбрел ліо у дозі 50 мг (дві підшкірні ін’єкції по 25 мг), що вводився 1 раз на тиждень, порівняно з введенням препарату Енбрел ліо у дозі 25 мг 2 рази на тиждень. Профілі безпеки та ефективності режимів дозування 50 мг 1 раз на тиждень і 25 мг 2 рази на тиждень були аналогічними.
Дорослі пацієнти з аксіальним спондилоартритом без рентгенологічного підтвердження.
Ефективність препарату Енбрел ліо для пацієнтів з аксіальним спондилоартритом, який не можна виявити за допомогою рентгену (nr-AxSpa), оцінювалася у рандомізованому 12-тижневому подвійному сліпому плацебо-контрольованому дослідженні. У дослідженні брали участь 215 дорослих пацієнтів (модифікована популяція пацієнтів, які прийняли хоча б одну дозу препарату) з активним nr-AxSpa (віком 18–49 років), визначених як такі, що відповідають критеріям класифікації ASAS (Оцінювання Міжнародним співтовариством з питань спондилоартриту) стосовно аксіального спондилоартриту, але не відповідають зміненим нью-йоркським критеріям стосовно аксіального спондилоартриту. Пацієнти також повинні мати неналежну відповідь або непереносимість одного чи більше нестероїдних протизапальних засобів (NSAIDs). Під час подвійної сліпої стадії дослідження пацієнти отримували препарат Енбрел ліо у дозі 50 мг щотижня або плацебо протягом 12 тижнів. Первинне оцінювання ефективності (ASAS 40) показало 40 % поліпшення у щонайменше трьох з чотирьох груп ASAS та відсутність погіршення стану у представників інших груп. Після завершення подвійної сліпої стадії дослідження пацієнти брали участь у відкритій стадії, в якій вони приймали по 50 мг препарату Енбрел ліо щотижня протягом ще 92 тижнів. З метою оцінювання запалення на початку дослідження та через 12 та 104 тижні пацієнтам було виконано МРТ крижово-клубового суглобу і хребта.
Порівняно з плацебо результати лікування препаратом Енбрел ліо продемонстрували статистично значиме поліпшення стану для ASAS 40, ASAS 20 та ASAS 5/6. Значне поліпшення також спостерігалося стосовно часткової ремісії ASAS і BASDAI 50 (Індекс активності захворювання анкілозуючим спондилоартритом). Результати, отримані на 12 тиждень лікування, наведені у таблиці нижче.
Таблиця 5
Ефективність відповіді у плацебо-контрольованому дослідженні nr-AxSpa: відсоток пацієнтів, які успішно дійшли до кінця дослідження
*Деякі пацієнти не надали повних даних для кожної кінцевої точки.
**ASAS = Оцінювання Міжнародним співтовариством з питань спондилоартриту.
*** Індекс активності захворювання анкілозуючим спондилоартритом.
a pb c
На 12 тиждень за рейтингом SPARCC (Канадський дослідницький консорціум з питань спондилоартриту) було відмічено статистично значиме поліпшення стану крижово-клубових суглобів (ККС) за результатами МРТ пацієнтів, які приймали препарат Енбрел ліо. Скоригована середня величина від початку дослідження становила 3,8 для групи, яка приймала препарат Енбрел ліо (n=95), порівняно з 0,8 для групи, яка приймала плацебо (n=105) (p
Препарат Енбрел ліо продемонстрував статистично значиме більше поліпшення від початку дослідження до 12 тижня порівняно з плацебо у більшості випадків, пов’язаних з оцінкою якості життя та функціонального статусу, включаючи BASFI (Функціональний індекс анкілозуючого спондиліту), загальну оцінку стану здоров’я EuroQol 5D та Індекс фізичного здоров’я SF-36.
Клінічна відповідь у пацієнтів з nr-AxSpa, які приймали Енбрел ліо, з’являлася вже під час першого візиту (2-й тиждень) та підтримувалася протягом 2 років лікування. Поліпшення якості життя, пов’язаної зі станом здоров’я, і функціонального статусу також підтримувалося протягом 2 років терапії. Результати спостереження протягом 2 років не виявили нові дані з безпеки. На 104-й тиждень під час проведення рентгенографії хребта у 8 пацієнтів був відзначений двосторонній прогрес до 2-го ступеня тяжкості згідно з критеріями модифікованої Нью-Йоркської рентгенологічної класифікації, що вказує на аксіальну спондилоартропатію.
Дорослі пацієнти з бляшковим псоріазом.
Енбрел ліо рекомендується призначати пацієнтам, зазначеним у розділі «Показання до застосування». Пацієнти, «у яких відсутній ефект від лікування», у цільовій популяції характеризуються недостатньою клінічною відповіддю (індекс площі ураження тіла та тяжкості псоріазу (PASI) менше 50 або загальна оцінка стану пацієнта лікарем (PGA) «менше ніж добре») або загостренням хвороби під час лікування, яке проводилося у належних дозах впродовж достатнього періоду, щоб можна було оцінити відповідь, із застосуванням щонайменше кожного з трьох основних наявних методів системної терапії.
Ефективність препарату Енбрел ліо порівняно з іншими системними методами лікування пацієнтів з середнім та тяжким псоріазом (чутливим до застосування інших системних методів лікування) не оцінювалась під час досліджень безпосереднього порівняння препарату Енбрел ліо з іншими системними методами лікування. Натомість безпеку та ефективність препарату Енбрел ліо оцінювали у чотирьох рандомізованих подвійних сліпих плацебо-контрольованих дослідженнях. Первинним критерієм ефективності в усіх чотирьох дослідженнях була частина пацієнтів у кожній групі дослідження, які досягли PASI 75 (тобто не менше 75% покращення індексу PASI порівняно з вихідним показником) через 12 тижнів.
Дослідження 1 було другою фазою дослідження із залученням пацієнтів віком від 18 років з активним, але клінічно стабільним бляшковим псоріазом із ураженням не менше 10% площі поверхні тіла. 112 пацієнтів були рандомізовані для отримання препарату Енбрел ліо у дозі 25 мг (n = 57) або плацебо (n = 55) 2 рази на тиждень протягом 24 тижнів.
У дослідженні 2 брали участь 652 пацієнти з хронічним бляшковим псоріазом. Для включення у випробування використовували ті самі критерії, що і у дослідженні 1, додатково індекс PASI на момент скринінгу мав становити мінімум 10. Енбрел ліо вводили по 25 мг один раз на тиждень, по 25 мг два рази на тиждень або 50 мг два рази на тиждень протягом 6 місяців поспіль. Впродовж перших 12 тижнів лікування (подвійний маскований період дослідження) пацієнти отримували плацебо або препарат Енбрел ліо у одному з трьох зазначених вище дозувань. Через 12 тижнів лікування пацієнти з групи плацебо починали отримувати масковане лікування препаратом Енбрел ліо (25 мг два рази на тиждень); пацієнти з груп активного лікування продовжували отримувати ту саму дозу, що й була призначена їм спочатку за результатами рандомізації, до 24-го тижня.
Дослідження 3, у якому брали участь 583 пацієнти, мало такі ж самі критерії включення у випробування, що і дослідження 2. Під час дослідження пацієнти отримували по 25 мг або 50 мг препарату Енбрел ліо або плацебо два рази на тиждень протягом 12 тижнів, потім впродовж наступних 24 тижнів всі пацієнти відкрито отримували лікування препаратом Енбрел ліо у дозі 25 мг два рази на тиждень.
Дослідження 4, у якому брали участь 142 пацієнти, мало такі самі критерії включення у випробування, що і дослідження 2 і 3. Пацієнти отримували по 50 мг препарату Енбрел ліо або плацебо один раз на тиждень протягом 12 тижнів, а потім всі пацієнти відкрито отримували лікування препаратом Енбрел ліо у дозі 50 мг один раз на тиждень впродовж 12 тижнів.
У дослідженні 1 група пацієнтів, що отримувала Енбрел ліо, мала достовірно більшу частку пацієнтів з показником PASI 75 на тижні 12 (30%) порівняно з групою плацебо (2%) (р
наведені у таблиці 6.
Таблиця 6
Відповіді на лікування пацієнтів з псоріазом, отримані у дослідженні 2, 3, 4
*p ≤ 0,0001 відносно плацебо.
a У дослідженнях 2 та 4 на 24 тижні статистичні порівняння по відношенню до плацебо не проводилися, оскільки група плацебо почала отримувала Енбрел ліо 25 мг 2 рази на тиждень (2/тиж.) або 50 мг 1 раз на тиждень (1/тиж.) з 13 по 24 тиждень.
b Загальна статична дерматологічна оцінка. Повне очищення шкіри (0 балів) або майже повне очищення шкіри (від 0 до 1 балів) визначається за 5-бальною шкалою.
Серед пацієнтів з бляшковим псоріазом, які отримували Енбрел ліо, статистично достовірні відповіді порівняно з плацебо були очевидними вже під час першого візиту (через 2 тижні) та зберігалися впродовж 24 тижнів лікування.
Також у дослідженні 2 був передбачений період відміни препарату, протягом якого пацієнти, які на 24 тижні випробування досягли покращення показника PASI щонайменше на 50%, припиняли лікування. За відсутності лікування за пацієнтами спостерігали з метою виявлення синдрому рикошету (PASI ≥ 150% від вихідного рівня) та визначення часу виникнення рецидиву захворювання (втрата принаймні половини покращення, досягнутого на 24 тижні порівняно з вихідним рівнем). Під час відміни лікування симптоми псоріазу поступово поверталися, при цьому медіана часу до виникнення рецидиву захворювання становила 3 місяці. Не спостерігалося ані синдрому рикошету, ані пов’язаних із псоріазом серйозних побічних явищ. Були отримані деякі дані, які свідчили про користь повторного застосування препарату Енбрел ліо пацієнтам, у яких спостерігався ефект від лікування.
У дослідженні 3 більшість пацієнтів (77%), які спочатку були віднесені до групи, що отримувала препарат Енбрел ліо по 50 мг два рази на тиждень, а потім на 12 тижні його доза була зменшена до 25 мг два рази на тиждень, зберегла досягнутий ними показник PASI 75 до 36 тижня. У пацієнтів, які отримували 25 мг препарату два рази на тиждень протягом усього дослідження, показник PASI 75 продовжував покращуватись протягом 12 - 36 тижнів.
У дослідженні 4 частка пацієнтів, що досягли PASI 75, на 12 тижні (38%) була вищою у групі, яка отримувала Енбрел ліо, порівняно з такою у групі плацебо (2%) (р
У довгострокових (тривалістю до 34 місяців) відкритих дослідженнях, під час яких Енбрел ліо застосовувався безперервно, клінічна відповідь була стабільною, а безпека була порівнянною з тією, що спостерігалася у короткострокових дослідженнях.
Аналіз результатів клінічних досліджень не виявив будь-яких початкових характеристик захворювання, які б змогли допомогти лікарям у виборі потрібного варіанту дозування (періодичного або безперервного). Отже, вибір періодичного або безперервного варіанту лікування має ґрунтуватися на рішенні лікаря і індивідуальних потребах пацієнта.
Антитіла до препарату Енбрел ліо.
В сироватці крові деяких пацієнтів, що отримували етанерцепт, були виявлені антитіла до нього. Усі ці антитіла не були нейтралізуючими антитілами і, як правило, з часом зникали. Схоже, що кореляція між утворенням антитіл та клінічною відповіддю або побічними явищами відсутня.
Сукупні показники утворення антитіл до етанерцепту у пацієнтів, які отримували етанерцепт у призначених дозах під час клінічних випробувань впродовж періоду до 12 місяців, становили приблизно 6% у пацієнтів з ревматоїдним артритом, 7,5% у пацієнтів із псоріатичним артритом, 2% у пацієнтів з анкілозуючим спондилітом, 7% у пацієнтів із псоріазом, 9,7% у дітей із псоріазом і 4,8% пацієнтів з ювенільним ідіопатичним артритом.
Як і очікувалося, під час довгострокових досліджень (тривалістю до 3,5 року) частина учасників дослідження, у яких виникли антитіла до етанерцепту, збільшувалася з часом. Однак через їх транзиторний характер частота виявлення антитіл у кожний момент визначення, як правило, була менше 7% у пацієнтів з ревматоїдним артритом та пацієнтів з псоріазом.
У довгостроковому дослідженні серед пацієнтів з псоріазом, під час якого вони отримували дозу 50 мг 2 рази на тиждень протягом 96 тижнів, частота виявлення антитіл у кожний момент проведення оцінювання сягала приблизно 9%.
Діти
Безпеку та ефективність препарату Енбрел ліо оцінювали у дослідженні, що складалося з двох частин і проводилося із залученням 69 дітей з поліартикулярним ювенільним ідіопатичним артритом та різними типами початку захворювання ювенільним ідіопатичним артритом (поліартрит, олігоартрит із системним початком). До нього були включені пацієнти віком від 4 до 17 років з середнім та тяжким активним поліартикулярним ювенільним ідіопатичним артритом, нечутливі до метотрексату або із непереносимістю цього препарату; пацієнти продовжували отримувати стабільну дозу одного нестероїдного протизапального препарату та/або преднізолону (
Під час першої частини цього дослідження всім пацієнтам застосовували Енбрел ліо із розрахунку 0,4 мг/кг (максимальна разова доза 25 мг) підшкірно 2 рази на тиждень. Під час другої частини цього дослідження була проведена оцінка загострення хвороби після рандомізованого розподілення всіх пацієнтів, у яких на 90 день спостерігалася клінічна відповідь на лікування, на 2 групи для продовження лікування препаратом Енбрел ліо або отримання плацебо протягом 4 місяців. Відповіді на лікування оцінювалися згідно із визначенням покращення стану при ювенільному ревматоїдному артриті (ЮРА), який характеризується покращенням не менше ніж на 30% принаймні 3 із 6 і погіршення не більше ніж на 30% не більш ніж 1 з 6 основних критеріїв оцінки ЮРА, до яких належать кількість суглобів з ознаками активного запалення, обмеження рухливості, загальна оцінка стану лікарем та пацієнтом/батьками, оцінка функціонального стану та швидкість осідання еритроцитів (ШОЕ). Загострення хвороби визначалося як погіршення не менше ніж на 30% 3 із 6 основних критеріїв оцінки ЮРА і покращення не більше ніж на 30% не більше ніж 1 із 6 основних критеріїв оцінки ЮРА, а також наявність щонайменш 2 суглобів із ознаками активного запалення.
У першій частині дослідження 51 з 69 пацієнтів (74%) продемонстрував клінічну відповідь на лікування та перейшов до другої частини дослідження. У другій частині дослідження загострення хвороби виникло у 6 з 25 (24%) пацієнтів, що продовжували отримувати Енбрел ліо, порівняно з 20 з 26 (77%) пацієнтів, що отримували плацебо (р = 0,007). Медіана часу від початку проведення другої частини дослідження і до виникнення загострення становила ≥ 116 днів у пацієнтів, які отримували Енбрел ліо, та 28 днів у пацієнтів, які отримували плацебо. Серед пацієнтів, у яких спостерігалася клінічна відповідь через 90 днів і які увійшли до другої частини дослідження, деякі пацієнти, які залишилися на препараті Енбрел ліо, продовжували відчувати поліпшення стану з 3 по 7 місяць, в той час як стан тих, хто отримував плацебо, не поліпшився.
У відкритому дослідженні з безпеки 58 пацієнтів (віком від 4 років на момент початку дослідження), які брали участь у дослідженні, описаному вище, продовжували отримувати Енбрел ліо впродовж періоду до 10 років. Рівень розвитку тяжких побічних реакцій та тяжких інфекцій не підвищився при довготривалому застосуванні.
Оцінка довготривалого застосування (протягом періоду до 3 років) монотерапії препаратом Енбрел ліо (n=103), комбінації Енбрел ліо та метотрексат (n=294), монотерапії метотрексатом (n=197) проводилась із залученням зареєстрованих 594 дітей віком від 2 до 18 років з ювенільним ідіопатичним артритом, з яких 39 дітей були віком від 2 до 3 років. Загалом частіше про виникнення інфекції повідомлялось при проведенні лікування етанерцептом, ніж метотрексатом (3,8% та 2% відповідно), до того ж, інфекції, пов’язані із застосуванням етанерцепту мали більш тяжкий характер.
В іншому відкритому неконтрольованому дослідженні 60 пацієнтам з олігоартритом (15 пацієнтів віком від 2 до 4 років, 23 пацієнти – від 5 до 11 років, 22 пацієнти – від 12 до 17 років), 38 пацієнтам з ентезитним артритом (віком від 12 до 17 років) та 29 пацієнтам з псоріатичним артритом (віком від 12 до 17 років) застосовували Енбрел ліо у дозуванні 0,8 мг/кг (максимальна доза становила 50 мг) 1 раз на тиждень впродовж 12 тижнів. Для кожного підтипу ЮРА більшість пацієнтів досягла ACR Pedi 30 критеріїв та продемонструвала клінічне покращення для вторинної контрольної точки: кількість суглобів з болем та загальний огляд лікаря. Профіль безпеки співпадав з профілями безпеки, що були отримані в інших дослідженнях ЮРА.
Дослідження оцінки ефективності продовження терапії препаратом Енбрел ліо для пацієнтів з ювенільним ідіопатичним артритом, які не відповіли на лікування протягом 3 місяців, не проводилось. Також не проводились дослідження оцінки наслідків відміни або зменшення дозування рекомендованих дозувань препарату Енбрел ліо після довготривалого застосування пацієнтам з ювенільним ідіопатичним артритом.
Діти
Ефективність препарату Енбрел ліо оцінювали в рандомізованому подвійному сліпому плацебо-контрольованому дослідженні за участю 211 дітей віком від 4 до 17 років із псоріазом від помірного до тяжкого ступеня (який характеризувався такими показниками: індекс sPGA не менше 3 балів, уражена площа поверхні тіла не менше 10%, індекс PASI не менше 12). Для задоволення критеріїв придатності участі у дослідженні пацієнти повинні в минулому отримувати фототерапію чи системну терапію або не досягти належного контролю над захворюванням при проведенні місцевого лікування.
Пацієнтам вводили Енбрел ліо із розрахунку 0,8 мг/кг (максимум 50 мг) або плацебо 1 раз на тиждень протягом 12 тижнів. На 12 тижні дослідження пацієнтів, які мали позитивну відповідь на лікування, було більше серед учасників, які за результатами рандомізації застосовували Енбрел ліо (наприклад, PASI 75), ніж серед тих, які були рандомізовані для застосування плацебо.
Таблиця 7
Результати лікування дітей з бляшковим псоріазом через 12 тижнів
По закінченню 12-ти тижневого подвійного сліпого періоду лікування усі пацієнти отримували Енбрел ліо із розрахунку 0,8 мг/кг (максимум 50 мг) один раз на тиждень протягом 24 додаткових тижнів. Відповіді на лікування, що спостерігалися під час відкритого періоду, були аналогічні тим, що спостерігалися під час подвійного сліпого періоду.
Під час рандомізованого періоду відміни препарату у достовірно більшої кількості пацієнтів, які за результатами повторної рандомізації отримували плацебо, виник рецидив захворювання (втрата PASI 75) порівняно з пацієнтами, які за результатами повторної рандомізації отримували Енбрел ліо. При продовженні терапії відповідь на лікування зберігалася впродовж періоду до 48 тижнів.
Довгострокова безпека та ефективність препарату Енбрел ліо у дозуванні 0,8 мг/кг (максимальна доза 50 мг) 1 раз на тиждень були оцінені у відкритому існуючому дослідженні із залученням 181 дитини з бляшковим псоріазом тривалістю до 2 років поза 48 тижнями досліджень, які описані вище. Довгострокові дослідження застосовування препарату Енбрел ліо були загалом порівнянні з оригінальними 48-тижневими дослідженнями. Відмінностей у безпеці знайдено не було.
Фармакокінетика.
Концентрації етанерцепту у плазмі крові визначалися методом імуноферментного аналізу (ELISA), який може виявляти ELISA-хімічно активні продукти розпаду, а також вихідну сполуку.
Всмоктування.
Етанерцепт повільно абсорбується з місця підшкірної ін’єкції, досягаючи максимальної концентрації приблизно через 48 годин після введення однократної дози. Абсолютна біодоступність становить 76%. При введенні препарату 2 рази на тиждень очікується, що рівноважні концентрації будуть вдвічі вищі за ті, що спостерігаються після введення разових доз. Після однократного підшкірного введення 25 мг етанерцепту середня максимальна концентрація в плазмі здорових добровольців становила (1,65 ± 0,66) мкг/мл, площа під кривою «концентрація – час» (AUC) – (235 ± 96,6) мкг• год/мл.
При введенні 50 мг препарату Енбрел ліо один раз на тиждень (n = 21) та введенні 25 мг препарату Енбрел ліо два рази на тиждень (n = 16) показники середньої концентрації у сироватці при рівноважному стані у пацієнтів з ревматоїдним артритом, які отримували лікування, становили: Cmax – 2,4 мг/л проти 2,6 мг/л, Cmin – 1,2 мг/л проти 1,4 мг/л і часткова AUC – 297 мг•год/л проти 316 мг•год/л відповідно. У відкритому перехресному дослідженні однократної дози з двома видами лікування, що проводилося за участю здорових добровольців, однократна ін’єкція 50 мг/мл етанерцепту була біоеквівалентною двом одночасним ін’єкціям препарату по 25 мг/мл.
За даними популяційного фармакокінетичного аналізу, проведеного у пацієнтів з анкілозуючим спондилітом, AUC етанерцепту у рівноважному стані дорівнювала 466 мкг•год/мл і 474 мкг•год/мл при введенні препарату Енбрел ліо у дозі 50 мг один раз на тиждень (N = 154) та 25 мг два рази на тиждень (N = 148) відповідно.
Розподіл.
Залежність концентрації етанерцепту від часу описується біекспоненціальною кривою. Центральний об’єм розподілу становить
Виведення.
Етанерцепт повільно виводиться з організму. Період напіввиведення є тривалим і становить приблизно 70 годин. У пацієнтів з ревматоїдним артритом кліренс становить приблизно 0,066 л/год, що трохи нижче цього показника у здорових добровольців (0,11 л/год). Фармакокінетика етанерцепту у пацієнтів з ревматоїдним артритом, анкілозуючим спондилітом та бляшковим псоріазом є подібною.
Явних відмінностей фармакокінетики етанерцепту у чоловіків і жінок немає.
Лінійність.
Офіційно пропорційність доз не досліджувалась, але немає видимого насичення кліренсу для будь-якого дозування.
Особливі популяції
Пацієнти з порушенням функції нирок.
Хоча виведення радіоактивної речовини після введення радіоактивно міченого етанерцепту пацієнтам та здоровим добровольцям відбувається із сечею, у пацієнтів з гострою нирковою недостатністю зростання концентрацій етанерцепту у плазмі не спостерігалося. Порушення функції нирок не вимагає корекції дози.
Пацієнти з порушенням функції печінки
Збільшення концентрації етанерцепту не спостерігалося у пацієнтів з гострою печінковою недостатністю. Порушення функції печінки не вимагає корекції дози.
Пацієнти літнього віку
У популяційному фармакокінетичному аналізі було досліджено вплив літнього віку на фармакокінетику препарату. Розраховані показники кліренсу та об’єму розподілу у пацієнтів віком від 65 до 87 років були подібні до таких у пацієнтів віком до 65 років.
Діти
У дослідженні із залученням 69 дітей віком від 4 до 17 років з поліартикулярним ювенільним ідіопатичним артритом препарат Енбрел ліо вводили із розрахунку 0,4 мг/кг маси тіла 2 рази на тиждень впродовж 3 місяців. Профілі концентрації у сироватці були аналогічними таким у дорослих пацієнтів з ревматоїдним артритом. У наймолодших дітей (4 роки) кліренс був зниженим (при стандартизації за масою тіла кліренс був збільшений) порівняно з дітьми старшого віку (12 років) та дорослими. Моделювання дозування дозволяє припустити, що у дітей старшого віку (10-17 років) і дорослих пацієнтів концентрації етанерцепту в плазмі крові приблизно однакові, а у дітей молодшого віку вони будуть істотно нижчими.
Діти з псоріазом
Діти з бляшковим псоріазом (віком від 4 до 17 років) отримували етанерцепт із розрахунку 0,8 мг/кг маси тіла (максимальна доза 50 мг на тиждень) один раз на тиждень впродовж періоду до 48 тижнів. Середні рівноважні концентрації етанерцепту в плазмі крові були в межах від 1,6 до 2,1 мкг/мл на 12, 24 та 48 тижні. Вищезазначені середні концентрації у дітей з бляшковим псоріазом були подібні до тих, що спостерігалися у дітей з ювенільним ідіопатичним артритом при застосуванні етанерцепту із розрахунку 0,4 мг/кг 2 рази на тиждень (максимальна доза 50 мг на тиждень). Ці значення були подібними таким у дорослих пацієнтів з бляшковим псоріазом, які отримували етанерцепт у дозі 25 мг 2 рази на тиждень.
Клінічні характеристики
Показання
Ревматоїдний артрит.
Енбрел ліо у комбінації з метотрексатом показаний для лікування активного ревматоїдного артриту від помірного до тяжкого ступеня у дорослих у випадках, коли відповідь на базові протиревматичні препарати, включаючи метотрексат (за відсутності протипоказань), є недостатньою.
Препарат може призначатися у вигляді монотерапії у випадку непереносимості метотрексату або коли тривале лікування метотрексатом є недоцільним.
Також Енбрел ліо показаний для лікування тяжкого активного і прогресуючого ревматоїдного артриту у дорослих пацієнтів, які раніше не отримували терапію метотрексатом.
Доведено, що Енбрел ліо, як у вигляді монотерапії, так і у комбінації з метотрексатом, уповільнює динаміку прогресування ураження суглобів (згідно з даними рентгенографії) та поліпшує їх функціональний стан.
Ювенільний ідіопатичний артрит.
Лікування поліартриту (ревматоїдний фактор позитивний або негативний) та поширеного олігоартриту у дітей віком від 2 років та підлітків, у яких спостерігається недостатня ефективність або непереносимість метотрексату.
Лікування псоріатичного артриту у дітей віком від 12 років у випадках відомої толерантності або недостатньої відповіді на терапію метотрексатом.
Лікування ентезитного артриту у дітей віком від 12 років у випадках відомої толерантності або недостатньої відповіді на традиційну терапію.
Застосування препарату Енбрел ліо дітям віком до 2 років не досліджувалось.
Псоріатичний артрит.
Лікування активного та прогресуючого псоріатичного артриту у дорослих у випадках недостатньої відповіді на терапію базовими протиревматичними препаратами. Енбрел ліо продемонстрував здатність покращувати фізичний стан пацієнтів з псоріатичним артритом та уповільнювати динаміку прогресування ураження периферичних суглобів (згідно даних рентгенографії) у пацієнтів з поліартикулярними симетричними підтипами захворювання.
Аксіальний спондилоартрит.
Анкілозуючий спондиліт.
Лікування дорослих з тяжким активним анкілозуючим спондилітом у разі недостатньої ефективності традиційної терапії.
Аксіальний спондилоартрит без рентгенологічного підтвердження.
Лікування дорослих пацієнтів з тяжкою стадією аксіального спондилоартриту без рентгенологічного підтвердження з об’єктивними симптомами запалення, на що вказує підвищений рівень С-реактивного білка та/або результати МРТ, та з недостатньою відповіддю на лікування нестероїдними протизапальними лікарськими засобами (НПЛЗ).
Бляшковий псоріаз.
Лікування дорослих пацієнтів з бляшковим псоріазом помірного або тяжкого ступеня та протипоказанням до застосування або непереносимістю іншої системної терапії, що включає циклоспорин, метотрексат, псорален та ультрафіолетове опромінення А (PUVA-терапія), або якщо це лікування було неефективним.
Бляшковий псоріаз у дітей.
Лікування хронічного тяжкого бляшкового псоріазу у дітей та підлітків віком від 6 років, у яких при застосуванні інших методів системної терапії або фототерапії не було досягнуто достатнього контролю над захворюванням або спостерігалась непереносимість такого лікування.
Протипоказання
Підвищена чутливість до діючої речовини або до будь-якої з допоміжних речовин.
Сепсис або ризик виникнення сепсису.
Не слід розпочинати лікування препаратом Енбрел ліо пацієнтів з активними інфекційними процесами, включаючи хронічні або локалізовані інфекції.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Супутнє застосування препарату анакінра.
У дорослих пацієнтів на фоні одночасного лікування препаратами Енбрел ліо та анакінра спостерігалося підвищення частоти виникнення тяжких інфекцій порівняно з пацієнтами, які отримували тільки Енбрел ліо або анакінру (за даними анамнезу).
Крім цього, у подвійному сліпому плацебо-контрольованому дослідженні, проведеному за участю дорослих пацієнтів, які на фоні лікування метотрексатом отримували препарати Енбрел ліо та анакінра, спостерігалося підвищення частоти виникнення тяжких інфекцій (7%) та нейтропенії порівняно із пацієнтами, які отримували лише Енбрел ліо (див. розділи «Особливості застосування» та «Побічні реакції»).
Комбінація препаратів Енбрел ліо та анакінри не продемонструвала підвищеної клінічної користі, тому вона не рекомендується до застосовування.
Супутнє застосування препарату абатацепт.
У клінічних дослідженнях супутнє застосування абатацепту і препарату Енбрел ліо призводило до підвищення частоти виникнення тяжких побічних реакцій. Така комбінація не продемонструвала підвищеної клінічної користі і тому не рекомендується до застосування.
Супутнє застосування препаратів Енбрел ліо та сульфасалазин.
В клінічному дослідженні із залученням дорослих пацієнтів, які на фоні лікування стандартними дозами сульфасалазину отримували Енбрел ліо, спостерігалося статистично значуще зниження середньої кількості лейкоцитів у пацієнтів, які лікувалися комбінацією, порівняно з пацієнтами, які отримували тільки Енбрел ліо або сульфасалазин. Клінічне значення цієї комбінації невідоме. Лікарі повинні бути обережними при призначені вищезазначеної комбінації.
Відсутність взаємодії.
У клінічних дослідженнях не спостерігалося жодних взаємодій при одночасному застосуванні препарату Енбрел ліо з глюкокортикостероїдами, саліцилатами (за винятком сульфасалазину), нестероїдними протизапальними препаратами, анальгетиками або метотрексатом. Стосовно рекомендацій щодо вакцинації див. розділ «Особливості застосування».
Не спостерігалося жодних клінічно значущих міжлікарських фармакокінетичних взаємодій під час досліджень з метотрексатом, дигоксином або варфарином.
Особливості застосування
Інфекції.
Пацієнтів необхідно обстежувати на наявність інфекцій до призначення препарату Енбрел ліо, під час лікування і після закінчення курсу терапії, враховуючи, що середній період напіввиведення етанерцепту становить приблизно 70 годин (7-300 годин).
При застосуванні препарату Енбрел ліо повідомлялося про розвиток тяжких інфекцій, сепсису, туберкульозу та опортуністичних інфекцій, включаючи інвазивні грибкові інфекції, лістеріоз, легіонельоз (див. розділ «Побічні реакції»). Ці інфекції були викликані бактеріями, мікобактеріями, грибами та вірусами, а також паразитами (включаючи найпростіших). У деяких випадках специфічний вид грибкової або іншої опортуністичної інфекції не був визначений, що призводило до затримки призначення необхідного лікування, а іноді до смерті. При обстеженні пацієнтів щодо наявності інфекцій слід брати до уваги ризик наявності у пацієнта певних опортуністичних інфекцій (наприклад вплив ендемічних мікозів).
Пацієнти, у яких на фоні лікування препаратом Енбрел ліо виникають нові інфекційні захворювання, повинні знаходитися під ретельним наглядом. У випадку розвитку тяжкої інфекції застосування препарату Енбрел ліо слід відмінити. Ефективність та безпечність застосування препарату Енбрел ліо у пацієнтів із хронічними інфекційними захворюваннями не оцінювалась. Лікарі повинні з обережністю призначати Енбрел ліо пацієнтам з рецидивуючими чи хронічними інфекціями в анамнезі або пацієнтам, основні захворювання яких можуть сприяти розвитку інфекції (наприклад прогресуючий або погано контрольований діабет).
Туберкульоз.
Повідомлялося про випадки виникнення активного туберкульозу, в тому числі міліарного туберкульозу та туберкульозу позалегеневої локалізації, у пацієнтів, які отримували Енбрел ліо.
Перед початком лікування препаратом Енбрел ліо усі пацієнти повинні бути обстежені щодо наявності як активного, так і неактивного (латентного) туберкульозу. Це обстеження повинно включати детальне вивчення медичного анамнезу, в тому числі індивідуального анамнезу захворювання на туберкульоз або можливих контактів з хворими на туберкульоз в минулому, і даних щодо проведеної раніше або поточної імуносупресивної терапії. Всім пацієнтам слід провести необхідні скринінгові тести, тобто туберкулінову шкірну пробу і рентгенографію легень (можна застосовувати місцеві рекомендації). Рекомендується занести інформацію щодо проведення цих обстежень у попереджувальну картку пацієнта (Patient Alert Card). Лікарям слід пам’ятати про ризик отримання хибнонегативних результатів туберкулінової шкірної проби, особливо у тяжкохворих пацієнтів або у осіб з ослабленим імунітетом.
У разі діагностування активного туберкульозу не слід розпочинати лікування препаратом Енбрел ліо. У випадку діагностування неактивного (латентного) туберкульозу перед початком застосування препарату Енбрел ліо необхідно провести протитуберкульозну терапію латентного туберкульозу згідно з місцевими рекомендаціями. У такій ситуації слід ретельно проаналізувати співвідношення користь/ризик лікування препаратом.
Всі пацієнти повинні бути проінформовані про необхідність звернутися до лікаря у разі появи під час або після лікування препаратом Енбрел ліо ознак або симптомів, характерних для туберкульозу (наприклад, постійний кашель, виснаження/втрата маси тіла, субфебрильна температура тіла).
Реактивація гепатиту В.
Повідомлялося про виникнення випадків реактивації гепатиту В у пацієнтів, які були раніше інфіковані вірусом гепатиту В і отримували супутнє лікування антагоністами ФНП, у тому числі препаратом Енбрел ліо. Також повідомлялося про реактивацію гепатиту В у пацієнтів, які мали позитивний результат на наявність анти-НВс антитіл, але негативний на наявність HBsAg. Перед початком лікування препаратом Енбрел ліо пацієнтів слід обстежувати щодо наявності інфекції вірусу гепатиту В. Пацієнтам із позитивним результатом тесту щодо наявності інфікування вірусом гепатиту В рекомендується звернутися до лікаря, який має досвід у лікуванні гепатиту В. Енбрел ліо слід з обережністю застосовувати пацієнтам, які були раніше інфіковані вірусом гепатиту В. Необхідно проводити ретельний моніторинг таких пацієнтів щодо симптомів гострої інфекції, викликаної вірусом гепатиту В, протягом усього лікування та впродовж декількох тижнів після його закінчення. Достатніх даних щодо лікування пацієнтів, інфікованих вірусом гепатиту В, комбінацією противірусних засобів та антагоністів ФНП немає. Пацієнтам, у яких спостерігається розвиток інфекції, спричиненої вірусом гепатиту В, лікування препаратом Енбрел ліо слід припинити та розпочати ефективне противірусне лікування разом із належною підтримуючою терапією.
Загострення гепатиту С.
Зареєстровані випадки загострення гепатиту С у пацієнтів, які отримують Енбрел ліо. Тому його слід із обережністю призначати пацієнтам з гепатитом С в анамнезі.
Супутнє лікування препаратом анакінра.
Супутнє застосування препаратів Енбрел ліо та анакінра супроводжувалося підвищеним ризиком виникнення тяжких інфекцій і нейтропенії порівняно із монотерапією препаратом Енбрел ліо. Така комбінація не продемонструвала збільшення клінічних переваг, тому її застосування не рекомендується (див. розділи «Побічні реакції» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Супутнє лікування препаратом абатацепт.
У клінічних дослідженнях супутнє застосування препаратів абатацепт і Енбрел ліо призвело до збільшення частоти виникнення серйозних побічних реакцій. Ця комбінація не показала збільшення клінічних переваг, тому таке застосування не рекомендується (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Алергічні реакції.
Ковпачок голки попередньо наповненого шприца містить латекс (суху натуральну гуму), який може спричинити реакції підвищеної чутливості у осіб з відомою або можливою чутливістю до латексу.
Введення препарату Енбрел ліо часто супроводжувалося виникненням алергічних реакцій.
Алергічні реакції включали ангіоневротичний набряк та кропив'янку; були випадки виникнення тяжких реакцій. При виникненні будь-яких тяжких алергічних або анафілактичних реакцій терапію препаратом Енбрел ліо слід негайно припинити та розпочати відповідне лікування.
Імуносупресія.
Не виключена можливість того, що антагоністи ФНП, включаючи Енбрел ліо, впливають на захисні механізми організму людини проти інфекцій і злоякісних новоутворень, оскільки ФНП бере участь у процесах запалення і модулює клітинну імунну відповідь. У дослідженні за участю 49 дорослих пацієнтів із ревматоїдним артритом, яким застосовували Енбрел ліо, не було виявлено випадків пригнічення реакцій гіперчутливості уповільненого типу, зниження рівня імуноглобуліну або зміни чисельності популяції клітин-ефекторів.
У двох пацієнтів з ювенільним ідіопатичним артритом виникла вітряна віспа та ознаки і симптоми асептичного менінгіту, які минули без ускладнень. Пацієнтам, які були у контакті з хворими на вітряну віспу, слід тимчасово припинити терапію препаратом Енбрел ліо та призначити профілактичне лікування імуноглобуліном проти вірусу Varicella Zoster.
Ефективність та безпека препарату Енбрел ліо у пацієнтів з пригніченим імунітетом або хронічними інфекціями не оцінювалися.
Злоякісні та лімфопроліферативні захворювання.
Солідні та онкогематологічні злоякісні новоутворення (за винятком раку шкіри)
У постмаркетинговому періоді (див. розділ «Побічні реакції») були отримані повідомлення про виникнення різних злоякісних новоутворень (включаючи карциному молочних залоз та легенів, а також лімфому).
Під час контрольованих клінічних досліджень антагоністів ФНП у пацієнтів, які отримували інгібітори ФНП, спостерігалося більше випадків розвитку лімфоми порівняно з контрольною групою пацієнтів. Однак ці випадки були поодинокими, а період спостереження за пацієнтами, які отримували плацебо, був коротшим, ніж за пацієнтами, які отримували лікування інгібіторами ФНП. У постмаркетинговому періоді повідомлялося про випадки розвитку лейкемії у пацієнтів, які отримували терапію антагоністами ФНП. У пацієнтів, які страждають на ревматоїдний артрит з довготривалим, високоактивним запальним захворюванням, існує підвищений вихідний ризик виникнення лімфоми або лейкемії, що ускладнює оцінку ризику.
Згідно з інформацією, актуальною на сьогоднішній день, не можна виключати можливий ризик розвитку лімфом, лейкемії або інших солідних та онкогематологічних злоякісних новоутвореньу пацієнтів, які отримують антагоністи ФНП. Слід проявляти обережність, аналізуючи необхідність терапії антагоністами ФНП пацієнтам зі злоякісними новоутвореннями в анамнезі або продовження терапії пацієнтам, у яких виникли злоякісні новоутворення.
У постмаркетинговому періоді були отримані повідомлення про виникнення злоякісних новоутворень, іноді з летальним наслідком, у дітей, підлітків та дорослих пацієнтів молодого віку (до 22 років), які отримували лікування антагоністами ФНП (лікування було розпочате у віці до 18 років), включаючи Енбрел ліо. Приблизно у половині випадків повідомлялося про розвиток лімфоми. Інші отримані повідомлення стосувалися виникнення ряду різних злоякісних новоутворень та включали поодинокі випадки типових злоякісних новоутворень, пов’язаних з імуносупресією. Ризик розвитку злоякісних новоутворень у дітей та підлітків, що отримують лікування антагоністами ФНП, не може бути виключений.
Рак шкіри.
У пацієнтів, які отримували лікування антагоністами ФНП, включаючи Енбрел ліо, були зареєстровані випадки розвитку меланоми та немеланомного раку шкіри (НМРШ). У постмаркетинговому періоді були отримані повідомлення (дуже рідко) про розвиток карциноми клітин Меркеля у пацієнтів, яких лікували препаратом Енбрел ліо. Рекомендується періодично проводити обстеження шкіри всім пацієнтам, особливо з факторами ризику виникнення раку шкіри.
Об’єднані результати контрольованих клінічних випробувань показали, що випадків розвитку НМРШ спостерігалося більше у пацієнтів, що отримували Енбрел ліо, порівняно із контрольною групою, особливо у хворих на псоріаз.
Вакцинації.
Не слід застосовувати живі вакцини одночасно з препаратом Енбрел ліо. Немає даних щодо вторинної передачі інфекції через живу вакцину пацієнтам, яких лікують препаратом Енбрел ліо. У подвійному сліпому плацебо-контрольованому рандомізованому клінічному дослідженні із залученням дорослих пацієнтів з псоріатичним артритом 184 пацієнти на 4-му тижні дослідження отримали пневмококову полівалентну полісахаридну вакцину. Більшість пацієнтів, які отримували Енбрел ліо, змогла сформувати ефективну гуморальну імунну відповідь на введення пневмококової полісахаридної вакцини, але титри загалом були дещо нижчими, і лише у декількох пацієнтів титри антитіл були вдвічі вищі за ті, що спостерігалися у пацієнтів, які не отримували Енбрел ліо. Клінічне значення цього факту невідоме.
Утворення аутоімунних антитіл.
Лікування препаратом Енбрел ліо може викликати утворення аутоімунних антитіл (див. розділ «Побічні реакції»).
Гематологічні реакції.
У пацієнтів, які отримували Енбрел ліо, були зафіксовані випадки панцитопенії (рідко) та випадки апластичної анемії (дуже рідко), у тому числі з летальним наслідком. Слід із обережністю призначати препарат Енбрел ліо пацієнтам, що мають в анамнезі гематологічні порушення (дискразію крові). Всіх пацієнтів та осіб, які доглядають за хворим, слід проінформувати про необхідність негайного звернення по медичну допомогу, якщо під час лікування препаратом Енбрел ліо у пацієнта виникають ознаки та симптоми, характерні для патологічних змін крові або інфекцій (наприклад стійке підвищення температури, біль у горлі, утворення синців, кровотеча, блідість). Необхідно негайно провести обстеження таких пацієнтів, включаючи повний аналіз крові; у випадку підтвердження гематологічного порушення лікування препаратом слід припинити.
Порушення з боку ЦНС.
У дорослих пацієнтів, які отримували Енбрел ліо, були випадки виникнення демієлінізуючих захворювань ЦНС (див. розділ «Побічні реакції»). Також дуже рідко повідомлялося про виникнення периферичних демієлінізуючих полінейропатій (включаючи синдром Гієна-Баре, хронічну запальну демієлінізуючу полінейропатію, демієлінізуючу полінейропатію та мультифокальну моторну нейропатію). Хоча клінічні дослідження із застосування препарату Енбрел ліо хворим на розсіяний склероз не проводилися, клінічні випробування інших інгібіторів ФНП показали підвищення активності захворювання (розсіяного склерозу). Перед призначенням препарату Енбрел ліо пацієнтам з існуючим або із нещодавно діагностованим демієлінізуючим захворюванням, а також пацієнтам, які входять до групи підвищеного ризику розвитку такого захворювання, рекомендується ретельно оцінити співвідношення користь/ризик, включаючи неврологічний статус.
Комбінована терапія.
У контрольованому клінічному дослідженні застосування комбінації препаратів Енбрел ліо і метотрексат тривалістю два роки, проведеному із залученням пацієнтів з ревматоїдним артритом, не було отримано неочікуваних результатів щодо безпеки. Профіль безпеки препарату Енбрел ліо був подібним до профілів, що спостерігалися при дослідженнях препаратів Енбрел ліо та метотрексат окремо. Довгострокові дослідження із вивчення безпеки цієї комбінації все ще тривають. Безпека довготривалого застосування препарату Енбрел ліо в комбінації з іншими базовими протиревматичними засобами не встановлена.
Застосування етанерцепту в комбінації з іншими системними методами лікування псоріазу або фототерапією не досліджувалося.
Порушення функції нирок та печінки.
Фармакокінетичні дані свідчать про те, що необхідності корегувати дозу пацієнтам з порушенням функції нирок або печінки немає; досвід клінічного застосування препарату таким пацієнтам обмежений.
Застійна серцева недостатність.
Лікарі повинні обережно призначати препарат Енбрел ліо пацієнтам із застійною серцевою недостатністю (ЗСН). У постмаркетинговому періоді надходили повідомлення про погіршення перебігу ЗСН у пацієнтів, які отримували Енбрел ліо, при цьому провокуючі фактори не завжди були виявлені. Крім того, були отримані повідомлення про поодинокі випадки (
Алкогольний гепатит.
У II фазі рандомізованого плацебо-контрольованого дослідження із залученням 48 госпіталізованих пацієнтів, які отримували Енбрел ліо або плацебо для лікування помірного та тяжкого алкогольного гепатиту, Енбрел ліо виявився неефективним і через 6 місяців смертність серед пацієнтів, які його отримували, була значно вищою. Таким чином, Енбрел ліо не слід застосовувати пацієнтам як засіб для лікування алкогольного гепатиту. Лікарі повинні із обережністю застосовувати Енбрел ліо пацієнтам із помірним та тяжким алкогольним гепатитом.
Гранулематоз Вегенера.
Плацебо-контрольоване дослідження, в якому 89 дорослих пацієнтів отримували Енбрел ліо додатково до стандартної терапії (у тому числі циклофосфамідом або метотрексатом і глюкокортикоїдами) впродовж в середньому 25 місяців, не продемонструвало його ефективності при лікуванні гранулематозу Вегенера. Частота розвитку злоякісних пухлин різного типу нешкірної локалізації була значно вищою у пацієнтів, які отримували Енбрел ліо, порівняно із пацієнтами контрольної групи. Тому Енбрел ліо не рекомендується застосовувати для лікування гранулематозу Вегенера.
Гіпоглікемія у пацієнтів, які отримують лікування від діабету
Повідомлялось про випадки розвитку гіпоглікемії після початку застосування препарату Енбрел ліо, пацієнтам, які отримують препарати, для лікування діабету, що призвело до необхідності зменшити дозування протидіабетичних препаратів деяким з цих пацієнтів.
Особливі популяції.
Пацієнти літнього віку.
У третій фазі досліджень із залученням хворих на ревматоїдний артрит, псоріатичний артрит та анкілозуючий спондиліт загалом не спостерігалось різниці у розвитку побічних реакцій, тяжких побічних реакцій та тяжких інфекцій у пацієнтів літнього віку (понад 65 років), які отримували препарат Енбрел ліо. Побічні реакціїі були подібними до таких у більш молодих пацієнтів. Однак необхідно бути обережним при лікуванні пацієнтів літнього віку і особливу увагу слід проявляти стосовно виникнення інфекцій.
Діти.
Вакцинації.
Рекомендується, щоб, за можливості, до початку лікування препаратом Енбрел ліо пацієнти дитячого віку отримали всі щеплення відповідно до чинного національного календаря щеплень (див. підрозділ Вакцинації).
Запальні захворювання травного тракту (ЗЗТТ) у пацієнтів з ювенільним ідіопатичним артритом.
Повідомлялось про виникнення ЗЗТТ та увеїту у пацієнтів з ювенільним ідіопатичним артритом на фоні застосування препарату Енбрел ліо (див. розділ «Побічні реакції»).
Застосування у період вагітності або годування груддю.
Вагітність.
Жінкам дітородного віку слід порадити використовувати належні способи контрацепції з метою уникнення вагітності під час застосування препарату Енбрел ліо та протягом 3 тижнів після закінчення терапії.
У спостережному дослідженні, в якому порівнювались вагітні пацієнтки, які отримували етанерцепт впродовж першого триместру, з вагітними пацієнтками, які не отримували етанерцепт або інші антагоністи ФНП, була зареєстрована підвищена частота серйозних вроджених вад розвитку (скориговане співвідношення шансів – 2,4, 95 % ДІ: 1,0–5,5). Типи серйозних вроджених вад розвитку відповідали найбільш поширеним у загальній популяції, та особливого характеру аномалій виявлено не було. Жодних змін частоти спонтанних викиднів, випадків мертвонародження або незначних вад розвитку не спостерігалося. Застосовувати препарат Енбрел ліо під час вагітності не рекомендується.
Етанерцепт проходить крізь плаценту та виявляється в сироватці немовлят, народжених жінками, які отримували лікування препаратом Енбрел ліо під час вагітності. Клінічна значущість цього спостереження невідома, однак немовлята можуть мати підвищений ризик розвитку інфекції. У цілому немовлятам не рекомендується проводити вакцинацію живими вакцинами протягом 16 тижнів після отримання матір’ю останньої дози препарату Енбрел ліо.
Годування груддю
Невідомо, чи виділяється етанерцепт із грудним молоком людини. Оскільки імуноглобуліни, як і багато інших лікарських засобів, можуть виділятися з молоком людини, слід прийняти рішення щодо або припинення годування груддю, або припинення застосування препарату Енбрел ліо. При прийнятті рішення слід брати до уваги користь від грудного годування для дитини та користь від терапії для матері.
Доклінічні дані стосовно пери- та постнатальної токсичності етанерцепту або впливу етанерцепту на фертильність та загальну репродуктивну здатність відсутні.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Дослідження із вивчення впливу препарату на здатність керувати транспортними засобами та працювати з механізмами не проводилися.
Спосіб застосування та дози
Перед застосуванням готують розчин препарату Енбрел ліо, використовуючи 1 мл води для ін’єкцій, препарат вводять підшкірно. Енбрел ліо не містить антибактеріальних речовин, і тому приготовлений розчин повинен бути використаний якомога швидше, але не пізніше ніж протягом 6 годин після приготування. Розчин повинен бути від безбарвного до ледь жовтуватого кольору, прозорим та не містити кусочків, пластівців та часточок. У флаконі може бути наявна незначна кількість піни білого кольору. Препарат не можна застосовувати, якщо весь порошок не розчинився протягом 10 хвилин (у цьому випадку необхідно використати інший флакон).
Лікування препаратом Енбрел ліо має призначатися та контролюватися лікарем, який має досвід у діагностиці та лікуванні ревматоїдного артриту, ювенільного ідіопатичного артриту, псоріатичного артриту, анкілозуючого спондиліту, аксіального спондилоартриту без рентгенологічного підтвердження, бляшкового псоріазу та бляшкового псоріазу у дітей.
Рекомендоване місце ін’єкції – середина передньої поверхні стегна. Альтернативно препарат можна вводити в ділянку живота, але не ближче 5 см від пупка, або в зовнішню поверхню плеча. Ін’єкцію виконують на відстані не менше 3 см від попереднього місця ін’єкції. Не слід вводити препарат в ушкоджене місце. Необхідно уникати введення Енбрел ліо у шрами, розтяжки та ділянки шкіри, уражені псоріазом. При необхідності виконання такої ін’єкції не слід вводити препарат у потовщену, червону, покриту лусочками шкіру.
Дозування.
Ревматоїдний артрит.
Рекомендована доза становить 25 мг препарату 2 рази на тиждень. Альтернативно може застосовуватися доза 50 мг 1 раз на тиждень, яка має доведену безпеку та ефективність.
Псоріатичний артрит, анкілозуючий спондиліт та аксіальний спондилоартрит без рентгенологічного підтвердження
Рекомендована доза становить 25 мг 2 рази на тиждень або 50 мг 1 раз на тиждень.
Для всіх вищезазначених показань наявні дані дають змогу припустити, що клінічна відповідь на застосування препарату з’являється протягом 12 тижнів від початку лікування. У разі, якщо у пацієнта немає відповіді на лікування протягом цього періоду, необхідно уважно переглянути доцільність продовження такої терапії.
Бляшковий псоріаз.
Рекомендована доза становить 25 мг препарату 2 рази на тиждень або 50 мг 1 раз на тиждень. Альтернативно Енбрел ліо можна застосовувати у дозуванні по 50 мг 2 рази на тиждень впродовж не більше 12 тижнів. Надалі, за необхідності лікування, можна застосовувати дозу 25 мг 2 рази на тиждень або 50 мг 1 раз на тиждень.
Терапію препаратом Енбрел ліо слід продовжувати до досягнення ремісії впродовж періоду не більше 24 тижнів. Для деяких дорослих пацієнтів може бути доцільним лікування, що триває понад 24 тижні (див. розділ Фармакодинаміка). Терапію препаратом слід відмінити при відсутності ефекту лікування через 12 тижнів від початку застосування препарату Енбрел ліо. За необхідності повторного призначення препарату, слід дотримуватися рекомендацій стосовно тривалості лікування, зазначених вище. Доза становить 25 мг препарату 2 рази на тиждень або 50 мг 1 раз на тиждень.
Особливі групи пацієнтів.
Пацієнти з порушенням функції нирок та печінки .
Потреби у корекції дози немає.
Пацієнти літнього віку.
Потреби у корекції дози немає. Дозування та спосіб застосування такі ж самі, як і для дорослих віком 18-64 роки.
Діти
Ювенільний ідіопатичний артрит (діти віком від 2 років).
Рекомендована доза становить 0,4 мг/кг маси тіла (максимальна разова доза 25 мг) 2 рази на тиждень у вигляді підшкірної ін’єкції з інтервалом між дозами 3-4 дні. За відсутності ефекту від лікування через 4 місяці від початку застосування препарату слід розглянути доцільність його відміни.
Офіційні клінічні дослідження застосування препарату Енбрел ліо дітям віком від 2 до 3 років не проводились. Однак обмежені дані з безпеки, отримані з реєстру пацієнтів, дають змогу припустити, що профіль безпеки у дітей віком від 2 до 3 років подібний до профілю безпеки у дорослих пацієнтів та дітей віком від 4 років при застосуванні препарату 1 раз на тиждень підшкірно у дозі 0,8 мг/кг.
Зазвичай Енбрел ліо не застосовують дітям віком до 2 років при ювенільному ідіопатичному артриті.
Бляшковий псоріаз у дітей (діти віком від 6 років).
Рекомендована доза становить 0,8 мг/кг (максимальна разова доза 50 мг) 1 раз на тиждень протягом періоду не більше 24 тижнів. За відсутності ефекту від терапії через 12 тижнів лікування слід припинити.
За необхідності повторного призначення препарату слід дотримуватися рекомендацій стосовно тривалості лікування, зазначених вище. Рекомендована доза становить 0,8 мг/кг (максимальна разова доза 50 мг) 1 раз на тиждень.
Зазвичай при бляшковому псоріазі Енбрел ліо не застосовують дітям віком до 6 років.
Передозування
Під час проведення клінічних випробувань із залученням пацієнтів з ревматоїдним артритом не було зареєстровано жодних токсичних явищ, які б вимагали обмеження дози. Найвищою дозою серед тих, що оцінювалися, була доза навантаження 32 мг/м2 (внутрішньовенно) з подальшим введенням 16 мг/м2 (підшкірно) 2 рази на тиждень. Один пацієнт з ревматоїдним артритом помилково самостійно вводив підшкірно по 62 мг препарату Енбрел ліо 2 рази на тиждень протягом 3 тижнів, при цьому жодних побічних ефектів у нього не виникло. Специфічний антидот для препарату Енбрел ліо невідомий.
Побічні реакції
Найчастіше повідомлялося про розвиток таких побічних реакцій: реакції у місці введення(такі як кровотеча у місці проколювання, почервоніння, свербіж, набряк, біль), інфекції (такі як інфекції верхніх дихальних шляхів, бронхіт, інфекції шкіри, інфекції сечового міхура), алергічні реакції, утворення антитіл, свербіж та лихоманка.
Також для препарату Енбрел ліо повідомлялося про виникнення тяжких побічних реакцій. Антагоністи ФНО, такі як Енбрел ліо, впливають на імунну систему, і їх застосування може мати вплив на імунний захист проти інфекцій та злоякісних пухлин. Тяжкі інфекції на фоні застосування препарату Енбрел ліо виникали менше ніж в 1 пацієнта із 100. Звіти включали повідомлення про виникнення сепсису, летальних інфекцій та інфекцій, що загрожують життю. При застосування препарату повідомлялося про виникнення різноманітних злоякісних пухлин, включаючи злоякісні пухлини грудної залози, легень, шкіри, лімфатичних вузлів (лімфома).
Повідомлялося про розвиток тяжких гематологічних, неврологічних та аутоімунних реакцій, включаючи повідомлення про панцитопенію (рідко) та апластичну анемію (дуже рідко). При застосуванні препарату Енбрел ліо повідомлялося про випадки центральної та периферичної демієлінізації (рідко та дуже рідко відповідно). Існують повідомлення про розвиток вовчака, патологічних станів, пов’язаних з вовчаком, васкуліту.
Наведений нижче перелік побічних реакцій ґрунтується на результатах клінічних випробувань у дорослих, а також на даних післяреєстраційного нагляду.
У кожному класі органів та систем побічні реакції наведені відповідно до частоти їх виникнення (кількості пацієнтів, у яких очікується розвиток цієї реакції) згідно із такими категоріями: дуже часто (≥ 1/10); часто (≥ 1/100,
Інфекції та інвазії.
Дуже часто: інфекції (включаючи інфекції верхніх дихальних шляхів, бронхіт, цистит, шкірні інфекції)*;
нечасто: тяжкі інфекції (включаючи пневмонію, целюліт, септичний артрит, сепсис, паразитарні інфекції)*;
рідко: туберкульоз, опортуністичні інфекції (включаючи інвазивні грибкові, протозойні, бактеріальні та атипові мікобактеріальні інфекції та інфекції, викликані Legionella)*;
невідомо: Listeria, реактивація гепатиту В.
Доброякісні, злоякісні та неспецифічні новоутворення (включаючи кісти та поліпи).
Нечасто: немеланомні злоякісні пухлини шкіри (див. розділ «Особливості застосування»);
рідко: лімфома, меланома (див. розділ «Особливості застосування»);
невідомо: лейкемія, карцинома клітин Меркеля (див. розділ «Особливості застосування»).
Порушення з боку крові та лімфатичної системи.
Нечасто: тромбоцитопенія;
рідко: анемія, лейкопенія, нейтропенія, панцитопенія*;
дуже рідко: апластична анемія*.
Порушення з боку імунної системи.
Часто: алергічні реакції (див. Порушення з боку шкіри та підшкірних тканин), утворення аутоантитіл*;
нечасто: системні васкуліти (включаючи васкуліти, позитивні до антинейтрофільних цитоплазматичних антитіл);
рідко: тяжкі алергічні/анафілактичні реакції (включаючи ангіоневротичний набряк, бронхоспазм), саркоїдоз;
частота невідома: синдром активації макрофагів*, погіршення симптомів дерматоміозиту.
Порушення з боку нервової системи.
Рідко: судоми; явища демієлінізації ЦНС, подібні до тих, що спостерігаються при розсіяному склерозі або станах локалізованої демієлінізації, таких як неврит зорового нерву та поперечний мієліт (див. розділ «Особливості застосування»);
дуже рідко: випадки периферичної демієлінізації, включаючи синдром Гієна-Баре, хронічну запальну демієлізуючу полінейропатію, демієлінізуючу полінейропатію та мультифокальну моторну нейропатію (див. розділ «Особливості застосування»).
Порушення з боку органів зору
Нечасто: увеїт, склерит.
Серцеві порушення
Рідко: застійна серцева недостатність (див. розділ «Особливості застосування»).
Респіраторні, торакальні та медіастинальні порушення
Нечасто: інтерстиціальне захворювання легенів (включаючи пневмоніт та фіброз легенів)*.
Гепатобіліарні порушення
Рідко: підвищення рівнів печінкових ферментів, аутоімунний гепатит.
Порушення з боку шкіри та підшкірних тканин
Часто: свербіж;
нечасто: ангіоневротичний набряк, кропивниця, висип, псоріазоформний висип, псоріаз (включаючи виникнення або погіршення захворювання та пустульозний псоріаз, переважно на долонях та підошвах);
рідко: шкірні форми васкуліту (включаючи лейкоцитокластичний васкуліт), синдром Стівенса-Джонсона, мультиформна еритема;
дуже рідко: токсичний епідермальний некроліз.
Порушення з боку скелетно-м’язової та сполучної тканини
Рідко: підгострий шкірний червоний вовчак, дискоїдний червоний вовчак, вовчакоподібний синдром.
Загальні розлади та реакції у місці введення
Дуже часто: реакції у місці введення (включаючи кровотечу, утворення підшкірної гематоми, еритему, свербіж, біль, набряк*);
часто: лихоманка.
*Опис побічних реакції наведено нижче.
Злоякісні утворення та лімфопроліферативні порушення.
129 випадків утворення нових злоякісних пухлин різного типу було виявлено у 4114 пацієнтів з ревматоїдним артритом, які отримували препарат Енбрел ліо під час клінічних випробувань впродовж приблизно до 6 років, в тому числі у 231 пацієнта, що отримували Енбрел ліо у комбінації з метотрексатом протягом 2-річного клінічного дослідження з активним контролем. Частота виникнення таких явищ та їх поширеність у вищезазначених клінічних дослідженнях були подібними до тих, що очікуються для популяції, яка брала участь у дослідженнях. У клінічних випробуваннях тривалістю приблизно 2 роки за участю 240 пацієнтів із псоріатичним артритом, які отримували препарат Енбрел ліо, загалом було зафіксовано 2 випадки виникнення злоякісних новоутворень. У клінічних дослідженнях застосування препарату Енбрел ліо тривалістю більше 2 років за участю 351 пацієнта з анкілозуючим спондилітом було зареєстровано 6 випадків виникнення злоякісних новоутворень. Повідомлялося про 30 випадків розвитку злоякісних новоутворень і 43 випадки немеланомного раку шкіри під час подвійних сліпих і відкритих досліджень тривалістю до 2,5 року із залученням 2711 пацієнтів з бляшковим псоріазом, які отримували лікування препаратом Енбрел ліо.
Повідомлялося про 18 випадків виникнення лімфоми під час клінічних досліджень застосування препарату Енбрел ліо із залученням 7416 пацієнтів з ревматоїдним артритом, псоріатичним артритом, анкілозуючим спондилітом та псоріазом.
Також були отримані повідомлення про випадки виникнення різних злоякісних новоутворень (у тому числі карциноми молочної залози, легенів та лімфоми) у постмаркетинговому періоді (див. розділ «Особливості застосування»).
Реакції в місці введення.
Порівняно з плацебо у пацієнтів з ревматичними захворюваннями, яким застосовували препарат Енбрел ліо, частота виникнення реакцій в місці ін'єкції була значно вищою (36% проти 9%). Реакції в місці ін'єкції зазвичай виникали впродовж першого місяця. Середня тривалість становила приблизно 3-5 днів. У більшості випадків лікування реакцій в місці ін'єкції не проводилося; більшість пацієнтів з тих, яким надавали лікування, отримувала препарати для місцевого застосування, такі як кортикостероїди, або пероральні антигістамінні препарати. Окрім того, у деяких пацієнтів виникали рецидиви реакції в місці ін'єкції, які характеризувалися появою шкірної реакції у місці здійснення останньої ін'єкції з одночасним виникненням реакцій на тих ділянках, де проводилися попередні ін'єкції. Ці реакції, як правило, носили тимчасовий характер та не виникали повторно під час подальшого лікування.
Під час контрольованих досліджень із залученням пацієнтів з бляшковим псоріазом протягом перших 12 тижнів лікування реакції в місці ін'єкції виникли приблизно у 13,6% пацієнтів, які отримували Енбрел ліо, порівняно з 3,4% пацієнтів, які отримували плацебо.
Тяжкі інфекції
У плацебо-контрольованих дослідженнях не спостерігалося збільшення частоти виникнення тяжких інфекцій (летальних, загрозливих для життя або тих, що вимагали госпіталізації чи внутрішньовенного введення антибіотиків). Тяжкі інфекції виникли у 6,3% пацієнтів з ревматоїдним артритом, що отримували Енбрел ліо впродовж періоду до 48 місяців. До них належали абсцес (різної локалізації), бактеріємія, бронхіт, бурсит, целюліт, холецистит, діарея, дивертикуліт, ендокардит (підозрюваний), гастроентерит, гепатит В, оперізуючий лишай, трофічні виразки нижніх кінцівок, інфекції ротової порожнини, остеомієліт, отит, перитоніт, пневмонія, пієлонефрит, сепсис, септичний артрит, синусит, інфекції шкіри, виразкове ураження шкіри, інфекції сечовивідних шляхів, васкуліт та ранова інфекція. Частота виникнення серйозних інфекцій під час 2-річного дослідження з активним контролем в усіх групах була аналогічною (пацієнти отримували лікування препаратом Енбрел ліо або метотрексатом як монотерапію або препаратом Енбрел ліо у комбінації з метотрексатом). Однак не можна виключати, що застосування комбінації препарату Енбрел ліо з метотрексатом може асоціюватися зі збільшенням частоти виникнення інфекцій.
Під час плацебо-контрольованих випробувань тривалістю до 24 тижнів не було виявлено різниці у частоті виникнення інфекційних захворювань у пацієнтів з бляшковим псоріазом, яким застосовували препарат Енбрел ліо або плацебо. Тяжкі інфекції, що спостерігалися у пацієнтів, яких лікували препаратом Енбрел ліо, включали целюліт, гастроентерит, пневмонію, холецистит, остеомієліт, гастрит, апендицит, асцит, зумовлений стрептококами, міозит, септичний шок, дивертикуліт та абсцес. 1 пацієнт повідомив про виникнення тяжкої інфекції (пневмонії) під час проведення подвійних сліпих та відкритих досліджень застосування цього препарату при псоріатичному артриті.
Під час застосування препарату Енбрел ліо були зареєстровані тяжкі та летальні інфекції бактеріальної, мікобактеріальної (включаючи мікобактерії туберкульозу), вірусної та грибкової етіології. Деякі з них виникали протягом декількох тижнів від початку застосування препарату Енбрел ліо у пацієнтів, які, крім ревматоїдного артриту мали основні захворювання (наприклад цукровий діабет, застійну серцеву недостатність, активні або хронічні інфекції в анамнезі) (див. розділ «Особливості застосування»). Застосування препарату Енбрел ліо може збільшити смертність у пацієнтів з діагностованим сепсисом.
Повідомлялося про виникнення опортуністичних інфекцій, в тому числі інвазивних грибкових, протозойних, бактеріальних (включаючи викликаних такими збудниками, як Listeria та Legionella) і атипових мікобактеріальних інфекцій, пов’язаних із застосуванням препарату Енбрел ліо. Згідно із сукупними даними, отриманими у клінічних випробуваннях, для 15 402 учасників досліджень, які отримували Енбрел ліо, загальна частота виникнення опортуністичних інфекцій становила 0,09%. Цей показник, скорегований з урахуванням експозиції, становив 0,06 випадків на 100 пацієнто-років. За даними постмаркетингового спостереження приблизно половина повідомлень з усього світу про розвиток опортуністичних інфекцій становили повідомлення про інвазивні грибкові інфекції. Найбільш поширеними з яких були інфекції, викликані Pneumocystis та Aspergillus.
Причиною більше ніж половини всіх випадків смерті пацієнтів, у яких розвинулися опортуністичні інфекції, були інвазивні грибкові інфекції. Більшість випадків з летальним наслідком сталися у пацієнтів з пневмоцистною пневмонією, невстановленою системною грибковою інфекцією та аспергильозом (див. розділ «Особливості застосування»).
Аутоантитіла
Зразки сироватки крові дорослих пацієнтів досліджували на наявність аутоантитіл у кількох контрольних часових точках. Серед пацієнтів з ревматоїдним артритом, у яких оцінювали наявність антинуклеарних антитіл (AНA), відсоток пацієнтів, які вперше стали позитивними стосовно утворення AНA (≥ 1:40), був вищим серед пацієнтів, які отримували Енбрел ліо (11%), порівняно із пацієнтами, які отримували плацебо (5%). Відсоток пацієнтів, які вперше стали позитивними щодо утворення антитіл до нативної дволанцюгової ДНК, також був вищим серед пацієнтів, які отримували Енбрел ліо (за даними радіоімунного аналізу: 15% пацієнтів, які отримували Енбрел ліо, та 4% пацієнтів, які отримували плацебо; за даними тесту з Crithidia luciliae 3% та 0% відповідно). Аналогічно кількість пацієнтів, які отримували лікування препаратом та у яких утворились антикардіоліпінові антитіла, була більшою порівняно з пацієнтами, які отримували плацебо. Вплив тривалого лікування препаратом Енбрел ліо на розвиток аутоімунних захворювань не відомий.
Надходили поодинокі повідомлення про пацієнтів, в тому числі із позитивним ревматоїдним фактором, у яких утворилися інші аутоантитіла із одночасним виникненням вовчакоподібного синдрому або висипів, які за своєю клінічною картиною та результатами біопсії нагадували підгострий шкірний вовчак або дискоїдний вовчак.
Панцитопенія та апластична анемія.
У постмаркетинговому періоді були отримані повідомлення про випадки виникнення панцитопенії та апластичної анемії, деякі з них мали летальний наслідок (див. розділ «Особливості застосування»).
Інтерстиціальне захворювання легенів.
У постмаркетинговому періоді були отримані повідомлення про випадки виникнення інтерстиціального захворювання легенів (включаючи пневмоніт та фіброз легенів), деякі з них мали летальний наслідок.
Супутнє лікування препаратом анакінра.
У дослідженнях, під час яких дорослі пацієнти одночасно отримували препарати Енбрел ліо та анакінра, частота виникнення тяжких інфекцій була вищою порівняно із такою при монотерапії препаратом Енбрел ліо. У 2% пацієнтів (3 із 139) розвинулася нейтропенія (абсолютне число нейтрофілів 3). На фоні нейтропенії в одного пацієнта розвинувся целюліт, який був вилікуваний в умовах стаціонару (див. розділи «Особливості застосування» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Діти.
Побічні ефекти у дітей з ювенільним ідіопатичним артритом.
У цілому побічні ефекти у дітей з ювенільним ідіопатичним артритом були подібними за частотою і типом до тих, що спостерігалися у дорослих пацієнтів. Відмінності від дорослих та інші специфічні дані, які потребують урахування, наведені нижче.
Типи інфекцій, що спостерігалися під час клінічних досліджень за участю пацієнтів з ювенільним ідіопатичним артритом віком від 2 до 18 років, як правило, були від легкого до помірного ступеня тяжкості та відповідали тим, що зазвичай зустрічаються у дітей, які лікуються амбулаторно. До зафіксованих тяжких побічних реакцій належали вітряна віспа з ознаками та симптомами асептичного менінгіту, які минали без будь-яких ускладнень (див. також розділ «Особливості застосування»), апендицит, гастроентерит, депресія/розлад особистості, виразкове ураження шкіри, езофагіт/гастрит, септичний шок, викликаний стрептококом групи А, цукровий діабет 1-го типу та інфекція м’яких тканин і післяопераційних ран.
В одному дослідженні із залученням дітей з ювенільним ідіопатичним артритом віком від 4 до 17 років під час застосування препарату Енбрел ліо протягом 3 місяців (перша відкрита частина дослідження) інфекція виникла у 62% дітей (43 з 69). Частота виникнення і тяжкість інфекцій у 58 пацієнтів, які завершили раніше розпочате лікування під час 12-місячного відкритого клінічного дослідження, були аналогічними. Види і співвідношення побічних явищ у пацієнтів з ювенільним ідіопатичним артритом були подібними до тих, що спостерігалися в дослідженнях препарату Енбрел ліо із залученням дорослих пацієнтів з ревматоїдним артритом. Більшість із них були легкими. Деякі побічні реакції спостерігалися частіше у 69 пацієнтів з ювенільним ідіопатичним артритом, які отримували лікування препаратом Енбрел ліо протягом 3 місяців, порівняно з 349 дорослими пацієнтами з ревматоїдним артритом. До них належать головний біль (19% пацієнтів, 1,7 випадку на одного пацієнта на рік), нудота (9%, 1,0 випадку на одного пацієнта на рік), біль у животі (19%, 0,74 випадку на одного пацієнта на рік) і блювання (13%, 0,74 випадку на одного пацієнта на рік).
Під час проведення клінічних випробувань серед пацієнтів з ювенільним ідіопатичним артритом зареєстровано 4 повідомлення про виникнення синдрому активації макрофагів.
У постмаркетинговому періоді були отримані повідомлення про випадки розвитку запалення кишечнику та увеїту у пацієнтів з ювенільним ідіопатичним артритом, які застосовували Енбрел ліо, включаючи незначну кількість випадків відновлення побічної реакції при повторному призначенні препарату (див. розділ «Особливості застосування»).
Побічні ефекти у дітей з бляшковим псоріазом.
У 48-тижневому дослідженні за участю 211 дітей з бляшковим псоріазом віком від 4 до 17 років виявлені побічні ефекти були подібними до тих, що спостерігалися у попередніх дослідженнях із залученням дорослих пацієнтів з бляшковим псоріазом.
Звітування про підозрювані побічні реакції.
Звітування про підозрювані побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу здійснювати безперервний моніторинг співвідношення користі та ризику, пов’язаних із застосуванням лікарського засобу. Медичних працівників просять звітувати про будь-які підозрювані побічні реакції.
Термін придатності
36 місяців (для порошку та розчинника).
Умови зберігання
Зберігати в оригінальній упаковці в недоступному для дітей місці в холодильнику при температурі від 2 до 8° С. Не заморожувати.
Препарат в межах терміну придатності можна зберігати протягом 4 тижнів при температурі не вище 25 °С. Препарат не можна повертати до холодильника, якщо його зберігали поза холодильником.
Приготований розчин слід використати негайно або протягом 6 годин після приготування розчину за умови зберігання при температурі не вище 25°С.
Несумісність
Не слід змішувати Енбрел ліо з іншими лікарськими засобами, оскільки дослідження сумісності етанерцепту не проводились.
Упаковка
Порошок по 25 мг у скляному флаконі по 4 мл з пробкою та з’ємною алюмінієвою пломбою та пластиковим ковпачком. 1 мл розчинника у попередньо наповненому скляному шприці. 2 флакони з порошком, 2 попередньо наповнених шприци, 2 окремі голки, 2 адаптери до флакону, 4 тампони зі спиртом поміщають у пластиковий контейнер. 2 пластикові контейнери разом з інструкцією про застосування поміщають у картонну коробку.
Категорія відпуску
За рецептом.
Виробник
Ваєт Фармасеутикалс / Wyeth Pharmaceuticals.
Місцезнаходження виробника та його адреса місця провадження діяльності
Нью Лейн, Хавант, PO9 2NG, Велика Британія / New Lane, Havant, PO9 2NG, United Kingdom.




