Иксджева / Xgeva деносумаб
- Состав
- Лекарственная форма
- Фармакотерапевтическая группа
- Показания
- Противопоказания
- Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
- Особенности применения
- Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
- Способ применения и дозы
- Передозировка
- Побочные реакции
- Срок годности
Склад
діюча речовина: деносумаб;
1 флакон (1,7 мл) містить 120 мг деносумабу (70 мг/мл);
допоміжні речовини: сорбіт (E 420), кислота оцтова льодяна, натрію гідроксид, вода для ін’єкцій.Лікарська форма
Розчин для ін’єкцій.Основні фізико-хімічні властивості: прозорий, безбарвний або жовтуватий розчин, що може містити незначну кількість від напівпрозорих до білих білковоподібних часток.
Фармакотерапевтична група
Лікарські засоби для лікування захворювань кісток. Інші лікарські засоби, що впливають на структуру та мінералізацію кісток.Код АТХ М05В Х04.
Імунологічні і біологічні властивості.
Фармакодинаміка.
Механізм дії.
RANKL існує як трансмембранний або розчинний білок. RANKL необхідний для утворення, функціонування та виживання остеобластів - єдиного типу клітин, відповідальних за резорбцію кісток. Підвищена активність остеокластів стимулюється RANKL – головним медіатором деструкції кісток при їх метастатичному ураженні та мієломній хворобі. Деносумаб – це людське моноклональне антитіло (IgG2), яке з високою афінністю та специфічністю направляється та зв’язується з RANKL, попереджаючи виникнення взаємодії RANKL/RANK і призводячи до зниження кількості та послаблення функції остеокластів, таким чином зменшуючи резорбцію та деструкцію кісток, індуковану раком.
Гігантоклітинні пухлини кісток характеризуються експресією ліганду RANK неопластичними стромальними клітинами та RANK остеокластоподібними гігантськими клітинами. У пацієнтів з гігантоклітинною пухлиною кісток деносумаб зв’язується з лігандом RANK, суттєво зменшуючи кількість або елімінуючи остеокластоподібні гігантські клітини. Як наслідок, зменшується остеоліз і проліферативна пухлинна строма заміщується непроліферативною диференційованою щільнотканинною новою кісткою.
Фармакодинамічні ефекти.
В клінічних дослідженнях фази ІІ серед пацієнтів з пізньою стадією злоякісних пухлин, які вражають кістки, підшкірне (п/ш) введення препарату Іксджева кожні 4 тижні або кожні 12 тижнів призводило до швидкого зниження маркерів резорбції кісток (uNTx/Cr, сироватковий CTx) із середнім зниженням на рівні приблизно 80% для uNTx/Cr, яке виникало протягом 1 тижня незалежно від попереднього лікування біфосфонатом або від вихідного рівня uNTx/Cr. В клінічних дослідженнях фази ІІІ середнє зниження на рівні приблизно 80% підтримувалося для uNTx/Cr через 3 місяці після початку лікування у 2075 пацієнтів із пізньою стадією раку, які отримували препарат Іксджева та не отримували внутрішньовенно біфосфонат.
Імуногенність.
В клінічних дослідженнях не було виявлено нейтралізуючих антитіл до препарату Іксджева. При застосуванні імуноферментного аналізу
Клінічна ефективність у пацієнтів з метастазами солідних пухлин в кістки.
Ефективність та безпечність препарату Іксджева в дозі 120 мг після підшкірного введення кожні 4 тижні або золедронової кислоти в дозі 4 мг (корекція дози при погіршеній функції нирок) після внутрішньовенного введення кожні 4 тижні порівнювалася в трьох рандомізованих, подвійних сліпих активно контрольованих дослідженнях, у пацієнтів, які раніше не отримували внутрішньовенно біфосфонат і мали пізню стадію злоякісної пухлини з ураженням кісток: дорослі з раком молочної залози (дослідження 1), інші солідні пухлини або мієломна хвороба (дослідження 2) та рак передміхурової залози, резистентний до кастрації (дослідження 3). Пацієнти з ОНЩ в анамнезі або остеомієлітом кісток щелепи, пацієнти з активним захворюванням зубів або щелеп, яким необхідне стоматологічне хірургічне втручання, пацієнти, у яких не загоїлися рани після стоматологічного втручання/хірургічне втручання в ротовій порожнині або пацієнти з будь-якими запланованими інвазивними процедурами не були придатними для включення в ці дослідження. Первинні та додаткові кінцеві точки оцінювали появу однієї або більше кісткових подій (КП). В дослідженнях, які демонструють більшу ефективність препарату Іксджева в порівнянні із золедроновою кислотою, пацієнтам пропонувався відкритий режим застосування препарату Іксджева в попередньо визначеній 2-річній розширеній фазі лікування.
Препарат Іксджева знижував ризик розвитку КП і розвиток множинних КП (перше та наступні) у пацієнтів з метастазами солідних пухлин в кістки (див. таблицю 1).
Таблиця 1. Результати дослідження ефективності у пацієнтів з пізніми стадіями злоякісних пухлин, які уражають кістки
|
|
Дослідження 1 рак молочної залози |
Дослідження 2 інші солідні пухлини** або мієломна хвороба |
Дослідження 3 рак передміхурової залози |
Поширений рак (комбіновані дані) |
|||||||||
|
|
ІКСДЖЕВА |
золедронова кислота |
ІКСДЖЕВА |
золедронова кислота |
ІКСДЖЕВА |
золедронова кислота |
ІКСДЖЕВА |
золедронова кислота |
|||||
|
N |
1026 |
1020 |
886 |
890 |
950 |
951 |
2862 |
2861 |
|||||
|
Перша КП |
|||||||||||||
|
Медіана часу (місяці) |
НД |
26,4 |
20,6 |
16,3 |
20,7 |
17,1 |
27,6 |
19,4 |
|||||
|
Різниця медіан часу (місяці) |
ДВ |
4,2 |
3,5 |
8,2 |
|||||||||
|
ВР (95% ДІ) /ЗВР (%) |
0,82 (0,71; 0,95) / 18 |
0,84 (0,71; 0,98) / 16 |
0,82 (0,71; 0,95) / 18 |
0,83 (0,76; 0,90) / 17 |
|||||||||
|
Р-значення не меншої ефективності/ більшої ефективності |
< 0,0001† / 0,0101† |
0,0007† / 0,0619† |
0,0002† / 0,0085† |
< 0,0001 / < 0,0001 |
|||||||||
|
Пропорція пацієнтів (%) |
30,7 |
36,5 |
31,4 |
36,3 |
35,9 |
40,6 |
32,6 |
37,8 |
|||||
|
Перша та наступна КП* |
|||||||||||||
|
Середня кількість/ пацієнти |
0,46 |
0,60 |
0,44 |
0,49 |
0,52 |
0,61 |
0,48 |
0,57 |
|||||
|
|
Дослідження 1 рак молочної залози |
Дослідження 2 інші солідні пухлини** або мієломна хвороба |
Дослідження 3 рак передміхурової залози |
Поширений рак (комбіновані дані) |
|||||||||
|
|
ІКСДЖЕВА |
золедронова кислота |
ІКСДЖЕВА |
золедронова кислота |
ІКСДЖЕВА |
золедронова кислота |
ІКСДЖЕВА |
золедронова кислота |
|||||
|
Відношення ризиків (95% ДІ) / ЗВР (%) |
0,77 (0,66; 0,89) / 23 |
0,90 (0,77; 1,04) / 10 |
0,82 (0,71; 0,94) / 18 |
0,82 (0,75; 0,89) / 18 |
|||||||||
|
Р-значення більшої ефективності |
0,0012† |
0,1447† |
0,0085† |
< 0,0001 |
|||||||||
|
ПКП в рік |
0,45 |
0,58 |
0,86 |
1,04 |
0,79 |
0,83 |
0,69 |
0,81 |
|||||
|
Перша КП або ГКЗ |
|||||||||||||
|
Медіана часу (місяці) |
НД |
25,2 |
19,0 |
14,4 |
20.3 |
17.1 |
26.6 |
19.4 |
|||||
|
ВР (95% ДІ) /ЗВР (%) |
0,82 (0,70; 0,95) / 18 |
0,83 (0,71; 0,97) / 17 |
0,83 (0,72; 0,96) / 17 |
0,83 (0,76; 0,90) / 17 |
|||||||||
|
Р-значення більшої ефективності |
0,0074 |
0,0215 |
0,0134 |
< 0,0001 |
|||||||||
|
Перше опромінення кісток |
|||||||||||||
|
Медіана часу (місяці) |
НД |
НД |
НД |
НД |
НД |
28,6 |
НД |
33,2 |
|||||
|
ВР (95% ДІ) /ЗВР (%) |
0,74 (0,59; 0,94) / 26 |
0,78 (0,63; 0,97) / 22 |
0,78 (0,66; 0,94) / 22 |
0,77 (0,69; 0,87) / 23 |
|||||||||
|
Р-значення більшої ефективності |
0,0121 |
0,0256 |
0,0071 |
< 0,0001 |
|||||||||
Примітки:
НД = не досягнуто; ДВ = дані відсутні; ГКЗ = гіперкальціємія при злоякісній пухлині; ПКП = поширеність кісткових подій; ВР = відношення ризиків; ЗВР = зниження відносного ризику; † - скореговані р-значення представлені з дослідженнь 1, 2 та 3 (перша КП, а також кінцеві точки першої та наступних КП); * - враховує всі кісткові події в динаміці; підраховуються тільки події, які виникли через ≥21 день після попередньої події; ** - включаючи НДРЛ (недрібноклітинний рак легень), нирково-клітинний рак, колоректальний рак, дрібноклітинний рак легень, рак сечового міхура, рак голови та шиї, рак ШКТ/сечостатевої системи та інших локалізацій, за виключенням раку молочної залози та раку передміхурової залози.
Зображення 1. Графіки Каплана-Мейера для часу першої КП, яке виникло під час дослідження
ЗК – золедронова кислота 4 мг, кожні 4 тижні
Дмаб – деносумаб 120 мг, кожні 4 тижні
![]()
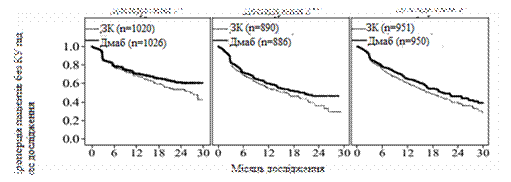
N = кількість рандомізованих пацієнтів
Примітки:
n = кількість рандомізованих пацієнтів;
*= cтатистично суттєво для більшої ефективності;
**= cтатистично суттєво для не меншої ефективності
Прогресування захворювання та загальна виживаність.
Прогресування захворювання було аналогічним між групами препарату Іксджева та золедронової кислоти в усіх трьох дослідженнях та в попередньо визначеному об’єднаному аналізі трьох досліджень.
В усіх трьох дослідженнях загальна виживаність була співставною між групами препарату Іксджева та золедронової кислоти у пацієнтів із поширеними стадіями злоякісних пухлин з ураженням кісток: пацієнти з раком молочної залози (відношення ризиків при 95% ДІ 0,95 [0,81; 1,11]), пацієнти з раком передміхурової залози (відношення ризиків при 95% ДІ 1,03 [0,91; 1,17]) та пацієнти з іншими солідними пухлинами або мієломною хворобою (відношення ризиків при 95% ДІ 0,95 [0,83; 1,08]). Ретроспективний аналіз в дослідженні 2 (пацієнти з іншими солідними пухлинами або мієломною хворобою) визначав загальну виживаність для 3 типів пухлин з використанням стратифікації (недрібноклітинний рак легень, мієломна хвороба та інші пухлини). Загальна виживаність була довшою для групи препарату Іксджева при недрібноклітинному раку легень (відношення ризиків [95% ДІ] 0,79 [0,65; 0,95]; n = 702) та довшою для групи золедронової кислоти при мієломній хворобі (відношення ризиків [95% ДІ] 2,26 [1,13; 4,50]; n = 180) та аналогічною для групи препарату Іксджева та золедронової кислоти при інших типах пухлин (відношення ризиків [95% ДІ] 1,08 (0,90; 1,30); n = 894). Це дослідження не контролювалося щодо прогностичних факторів та протипухлинного лікування. В об’єднаному попередньо визначеному аналізі досліджень 1, 2 та 3 загальна виживаність була аналогічною для групи препарату Іксджева та золедронової кислоти (відношення ризиків при 95% ДІ 0,99 [0,91; 1,07]).
Вплив на біль.
Час до зменшення болю (тобто, зниження на ≥2 бали від початкових значень за шкалою оцінки болю модифікованого короткого опитувальника оцінки болю BPI-SF) був аналогічним для деносумабу та золедронової кислоти в кожному дослідженні та в інтегрованих аналізах. В post-hoc аналізі комбінованих даних середній час до посилення болю (>4 балів посилення по шкалі болю) у пацієнтів з легким болем або без болю на вихідному рівні затримувався для препарату Іксджева у порівнянні із золедроновою кислотою (198 проти 143 днів) (p = 0,0002).
Клінічна ефективність у дорослих та підлітків з дозрілою кістковою системою, які мають гігантоклітинну пухлину кісток.
Безпечність та ефективність препарату Іксджева досліджувалася в двох відкритих непорівняльних дослідженнях фази ІІ (дослідження 4 та 5), які включали 529 пацієнтів з гігантоклітинними нерезектабельними пухлинами кісток або для яких хірургічне втручання пов’язувалося з тяжкою захворюваністю.
Дослідження 4 включало 37 дорослих пацієнтів з гістологічно підтвердженими нерезектабельними або рецидивуючими гігантоклітинними пухлинами кісток. Критерії відповіді на лікування включали елімінацію гігантських клітин за даними патогістологічного дослідження або відсутність прогресування при рентгенографії.
З 35 пацієнтів, включених в аналіз ефективності, 85,7% (95% ДІ: 69,7; 95,2) відповідали на лікування препаратом Іксджева. Всі 20 пацієнтів (100%), які відповіли на лікуання, мали відповідь за гістологічними критеріями. З 15 пацієнтів, які залишилися, 10 (67%) не показали прогресування цільового пухлинного осередку за результатами рентгенологічних досліджень.
Дослідження 5 включало 507 дорослих або підлітків з дозрілою кістковою системою, які мають гігантоклітинну пухлину кісток та осередки захворювання, що піддаються вимірюванню.
В когорті 1 (пацієнти з неоперабельним осередком захворювання), середній час до прогресування захворювання не був досягнутий, 21 з 258 пацієнтів, які отримували лікування, мали прогресування захворювання. В когорті 2 (пацієнти з операбельним осередком захворювання, у яких заплановане хірургічне втручання пов’язувалося з тяжкими наслідками), 209 з 228 придатних для оцінки пацієнтів, які отримували препарат Іксджева, не проходили хірургічного лікування до 6 місяця. Загалом, з 225 пацієнтів, у яких було заплановано оперативне втручання з приводу гігантоклітинних пухлин кісток (лише за виключенням метастазів у легені), у 109 операція не була проведена, у 84 - операцію було виконано в меншому об’ємі ніж планувалося на початку. Середній час до операції склав 261 день.
Після включення 305 пацієнтів в дослідження 4 та 5 було проведено ретроспективний незалежний огляд даних рентгенівських знімків. У 119 пацієнтів була щонайменше 1 часова точка реакції на лікування, придатна для оцінки, і вони були включені в аналіз (таблиця 2). Загалом, лікування препаратом Іксджева досягло об’єктивної відповіді пухлини у 71,6% (95% ДІ 64,6; 77,9) пацієнтів (таблиця 3), оціненої за допомогою певних методів. При цьому більшість відповідей реєструвалася за допомогою зменшення активності фтордеоксиглюкози при ПЕТ або збільшення щільності, визначеної в одХ (HU) на КТ, лише 25,1% пацієнтів мали реакцію на лікування за шкалою RECIST (Критерії оцінки відповіді при солідних пухлинах). Середній час до відповіді склав 3,1 місяці (95% ДІ 2,89; 3,65). Середню тривалість відповіді не можна було оцінити (у чотирьох пацієнтів відмічалося прогресування захворювання після об’єктивної відповіді). У 190 пацієнтів, яких можна було оцінити на ознаки відповіді пухлини на лікування, 55 пацієнтів пройшли хірургічне лікування гігантоклітинної пухлини кісток, з них у 40 пацієнтів була повна резекція.
Таблиця 2: Об’єктивна реакція на лікування у пацієнтів з гігантоклітинною пухлиною кісток
|
|
Кількість пацієнтів, придатних для оцінки реакції |
Кількість пацієнтів з об’єктивною реакцією |
Пропорція (%) (95% ДІ)1 |
|
На основі найкращої реакції |
190 |
136 |
71,6 (64,6; 77,9) |
|
RECIST 1.12 |
187 |
47 |
25,1 (19,1; 32,0) |
|
EORTC3 |
26 |
25 |
96,2 (80,4; 99,9) |
|
Щільність/розмір4 |
176 |
134 |
76,1 (69,1; 82,2) |
1ДІ= Точний довірчий інтервал
2RECIST 1.1: Модифікована шкала критеріїв оцінки відповіді при солідних пухлинах для оцінки поширеності пухлини на основі комп’ютерної томографії (КТ)/магнітно-резонансної томографії (МРТ)
3EORTC: Модифікована шкала критеріїв Європейської організації дослідження та лікування злоякісних пухлин для оцінки метаболічної відповіді за допомогою позитронно-емісійної томографії з фтордеоксиглюкозою (ПЕТ ФДГ)
4Щільність/розмір: Модифікована шкала зворотних критеріїв Choi для оцінки розміру та щільності пухлини за допомогою одиниць Хаусфілда на основі КТ/МРТ
Вплив на біль.
Після включення 282 пацієнтів в дослідження 5 в об’єднаній групі 1 та 2 когорт, повідомлялося про клінічно суттєве зменшення сильного болю (тобто зниження на ≥2 бали від вихідного рівня) у 31,4% пацієнтів групи ризику (тобто, у тих, хто мав найгірший бал по шкалі сильного болю ≥2 від вихідного рівня) протягом 1 тижня лікування, та ≥50% на 5 тижні. Це послаблення болю підтримувалося в усіх наступних оцінках. Застосування знеболення на вихідному рівні до початку лікування в когорті 1 та 2 оцінювалося по семибальній шкалі, де 74,8% пацієнтів повідомляли про те, що не застосовували знеболення або застосовували його помірно (тобто, бал знеболення ≤2) та 25,2% пацієнтів застосовували сильні опіоїди (тобто, бал знеболення від 3 до 7).
Діти.
Європейське агентство лікарських засобів тимчасово утрималось від зобов’язання передати результати досліджень по препарату Іксджева у всіх підгрупах дітей для попередження кісткових подій у пацієнтів з метастазами кісток та у підгрупах дітей молодших 12 років при лікуванні гігантоклітинної пухлини кісток (див. розділи «Спосіб застосування та дози» для отримання інформації щодо застосування у дітей).
В дослідженні 5 препарат Іксджева оцінювався в підгрупі з 18 підлітків (віком від 13 до 17 років) з гігантоклітинними пухлинами кісток з дозрілою кістковою системою. Зрілість визначалася за завершеним дозріванням щонайменше 1 трубчатої кістки (наприклад, закрита пластинка епіфізарного росту плечової кістки) та маси тіла ≥45 кг. Об’єктивна відповідь спостерігалася для чотирьох з шести придатних для оцінки підлітків в проміжному аналізі дослідження 5. Згідно з дослідницькою оцінкою, всі 18 підлітків мали часткову відповідь, стабілізацію захворювання або, навіть, повну відповідь (повна відповідь - у 2 пацієнтів, часткова – 8 пацієнтів, стабілізація - 8 пацієнтів). Європейське агентство лікарських засобів відклало передачу остаточних результатів цього дослідження.
Фармакокінетика.
Абсорбція. Після підшкірного введення біодоступність складала 62%.
Біотрансформація. Деносумаб складається виключно з амінокислот та вуглеводів, як і природний імуноглобулін. Тому малоймовірно, що він буде виводитися шляхом печінкового метаболізму. Вважається, що його метаболізм та виведення відбуваються тими ж шляхами, що і кліренс імуноглобуліну, призводячи до розпаду невеликих білків до окремих амінокислот.
Виведення. У пацієнтів із розповсюдженим раком при застосуванні багатократних доз по 120 мг кожні 4 тижні спостерігалося збільшення сироваткової концентрації деносумабу майже в 2 рази, а рівноважний стан досягався через 6 місяців, відповідно до фармакокінетики, незалежної від часу. У пацієнтів з гігантоклітинними пухлинами кісток, які отримували 120 мг кожні 4 тижні з навантажувальною дозою на 8 та 15 день, рівноважні рівні досягалися протягом першого місяця лікування. Між 9 та 49 тижнем середній мінімальний рівень коливався на менше ніж 9%. У пацієнтів, які припинили отримувати 120 мг кожні 4 тижні, середній період напіввиведення склав 28 днів (діапазон 14-55 днів).
Аналіз популяційної фармакокінетики не вказав на клінічно суттєві зміни системного впливу деносумабу в рівноважному стані залежно від віку (18-87 років), раси/етнічної групи (досліджені пацієнти з темним кольором шкіри, вихідці з Латинської Америки, пацієнти азійського походження та представники європеоїдної раси), статі або типів солідних пухлин. Збільшення маси тіла пов’язувалося зі зменшенням системного впливу і навпаки. Зміни не вважалися клінічно суттєвими, оскільки фармакодинамічні ефекти на основі маркерів кісткового ре-моделювання були відповідними в широкому діапазоні показника маси тіла.
Лінійність/нелінійність. Деносумаб відображав нелінійну фармакокінетику в широкому діапазоні доз, але майже дозопропорційне збільшення впливу для доз 60 мг (або 1 мг/кг) та вище. Нелінійність, наймовірніше, пов’язана з важливим шляхом виведення, опосередкованим мішенню, яка насичується, при низьких концентраціях.
Ниркова недостатність. В дослідженнях серед пацієнтів (60 мг, n=55 та 120 мг, n=32) без пізньої стадії раку, але з різним ступенем функції нирок, включаючи пацієнтів на діалізі, ступінь ниркової недостатності не впливала на фармакокінетику деносумабу; таким чином, немає необхідності в корекції дози при нирковій недостатності.
Печінкова недостатність. Не проводилося спеціальних досліджень за участю пацієнтів з печінковою недостатністю. Загалом, моноклональні антитіла не виводяться шляхом печінкового метаболізму. Не очікується, що печінкова недостатність буде впливати на фармакокінетику деносумабу.
Пацієнти літнього віку. Між пацієнтами літнього віку та молодими пацієнтами загалом не спостерігалося відмінностей, щодо безпеки або ефективності. Контрольовані клінічні дослідження у пацієнтів, які отримують препарат Іксджева, з пізніми стадіями злоякісних пухлин з ураженням кісток віком від 65 років, виявили аналогічну ефективність та безпеку як у старших пацієнтів, так і у молодших пацієнтів. Для пацієнтів літнього віку немає необхідності в корекції дози.
Діти. Фармакокінетичний профіль у дітей не оцінювався.
Дані доклінічних досліджень з безпеки.
Оскільки біологічна активність деносумабу у приматів специфічна, для оцінки фармакодинамічних властивостей деносумабу на моделях гризунів використовувались генно-модифіковані миші (технологія knockout) або інші біологічні інгібітори шляху RANK/RANKL, такі як OPG-Fc та RANK-Fc.
У моделях мишей із кістковими метастазами естроген рецептор-позитивного та негативного раку молочної залози, раку передміхурової залози та недрібноклітинного раку легень людини, OPG-Fc зменшував остеолітичні, остеобластичні та остеолітичні/остеобластичні руйнування, затримував формування denovo кісткових метастазів та стримував ріст пухлин в кістках. Якщо OPG-Fc поєднувався з гормональною терапією (тамоксифен) або хіміотерапією (доцетаксел), відмічалося додаткове пригнічення росту кісткових осередків раку молочної залози, передміхурової залози або раку легень, відповідно. У моделі миші з індукованою пухлиною молочної залози, RANK-Fc знижував опосередковану гормоном проліферацію епітелію молочної залози та затримував формування пухлини.
Стандартні тести для визначення потенціалу генотоксичності деносумабу не виконувались, оскільки такі тести не є релевантними для цієї молекули. Проте, малоймовірно, що деносумаб має будь-який потенціал до генотоксичності.
Канцерогенний потенціал деносумабу не оцінювався в довготривалих дослідженнях на тваринах. В дослідженнях токсичності однократної та багатократних доз на яванських макаках дози деносумабу, які призводили до системної відповіді, вищі в 2,7-15 разів, ніж рекомендована доза у людей, не мали впливу на фізіологію серцево-судинної системи, репродуктивну функцію самців або самок або на виникнення специфічної токсичності для органів-мішеней.
В дослідженні на яванських макаках, які отримували деносумаб протягом періоду, еквівалентного першому триместру вагітності, дози деносумабу, які призводили до системної відповіді, вищої в 9 разів, ніж рекомендована доза у людей, не викликали токсичної дії у матері або шкоди для плоду протягом періоду, еквівалентного першому триместру вагітності, хоча лімфатичні вузли плоду не досліджувалися.
В іншому дослідженні на яванських макаках, які отримували деносумаб протягом вагітності з системним впливом в 12 разів вищим, ніж доза у людини, відмічалося збільшення мертвонароджень та постнатальної смертності; патологічний ріст кісток, який призводив до зменшення міцності кісток, знижений гемопоез та неправильний прикус; відсутність периферичних лімфовузлів; сповільнення неонатального росту. Максимальна доза, яка не призводила до виникнення небажаних ефектів, що спостерігалися, не була встановлена. Через 6 місяців після народження зміни, пов’язані з кістками показали повернення до норми, не відмічалося впливу на прорізування зубів. Тим не менше, ефекти на лімфатичні вузли та прикус залишалися, і у однієї тварини спостерігалася мінімальна або середня мінералізація численних тканин (зв’язок з лікуванням не очевидний). Не було доказів шкоди для матері до пологів; небажані реакції у матері нечасто виникали під час пологів. Розвиток молочної залози матері був нормальним.
В доклінічних дослідженнях якості кісток на мавпах при тривалому лікуванні деносумабом, уповільнення ремоделювання пов’язувалося з покращенням міцності кісток та нормальними гістологічними параметрами кісток.
У самців мишей, які шляхом генної модифікації мали експресію huRANKL ( технологія knock-in mice) і піддавалися транскортикальному перелому, деносумаб затримував організацію хрящової тканини та ремоделювання кісткового мозолю у порівнянні з контролем, але біохімічна міцність не зазнавала небажаного впливу.
У доклінічних дослідженнях, миші із заблокованим геном RANK або RANKL не мали лактації у зв’язку з пригніченням дозрівання молочних залоз (лобуло-альвеолярний розвиток залоз під час вагітності) та демонстрували порушення утворення лімфовузлів. Новонароджені миші із заблокованим геном RANK/RANKL демонстрували зменшення маси тіла, послаблення росту кісткової тканини, порушення зон росту та відсутність прорізування зубів. Ослаблення росту кісткової тканини, порушення зон росту та відсутність прорізування зубів також відмічалися в дослідженнях на новонароджених щурах, яким вводили інгібітори RANKL, і ці зміни були частково оборотними після відміни інгібітору RANKL. У приматів підліткового віку, які отримували деносумаб в дозі в 2,7 та 15 разів (доза 10 та 50 мг/кг) вище за клінічну дозу, були патологічно змінені зони росту. Таким чином, лікування деносумабом може порушувати ріст кісткової тканини у дітей з відкритими зонами росту та може пригнічувати прорізування зубів.
Клінічні характеристики
Показання
Попередження кісткових подій (патологічний перелом, опромінення кісток, компресія спинного мозку або хірургічне втручання на кістках) у дорослих пацієнтів із метастатичним ураженням кісток солідними пухлинами.
Лікування дорослих та підлітків з дозрілою кістковою системою, які мають гігантоклітинну пухлину кісток, що не може бути видалена або, якщо хірургічна резекція найімовірніше призведе до тяжких наслідків.
Протипоказання
Підвищена чутливість до діючої речовини або до будь-якої допоміжної речовини.
Нелікована гіпокальціємія тяжкого ступеня (див. розділ «Особливості застосування»).
Ураження після стоматологічних або хірургічних втручань в ротовій порожнині, що не загоюються.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Дослідження взаємодії не проводилися. В клінічних дослідженнях препарат Іксджева застосовувався в комбінації зі стандартною протипухлинною терапією та у випадках попереднього лікування біфосфонатами. Не було клінічно значущих змін мінімальної сироваткової концентрації та фармакодинаміки деносумабу (N-телопептид сечі з поправкою на креатинін, uNTx/Cr) при одночасному застосуванні хіміотерапії та/або гормональної терапії або при попередньому внутрішньовенному введенні біфосфонату.
Особливості застосування
Додавання кальцію та вітаміну D. Додавання кальцію та вітаміну D необхідне для всіх пацієнтів, за винятком випадків гіперкальціємії (див. розділ «Спосіб застосування та дози»).
Гіпокальціємія. Існуючу гіпокальціємію необхідно коригувати до початку лікування препаратом Іксджева. Гіпокальціємія може виникнути в будь-який час протягом лікування препаратом Іксджева. Моніторинг рівнів кальцію слід проводити: перед введенням початкової дози препарату Іксджева, протягом двох тижнів після введення початкової дози, якщо виникають симптоми з підозрою на гіпокальціємію (див. розділ «Побічні реакції» для ознайомлення з симптомами). Необхідно розглянути додатковий моніторинг рівня кальцію під час лікування у пацієнтів з факторами ризику появи гіпокальціємії, або в інших випадках, залежно від клінічного стану пацієнта.
Пацієнти повинні повідомляти про симптоми, які вказують на гіпокальціємію. Якщо гіпокальціємія виникає під час лікування препаратом Іксджева, може виникнути потреба у додатковому застосуванні кальцієвих добавок та додатковому моніторингу.
В період післяреєстраційного застосування повідомлялося про тяжку симптоматичну гіпокальцемію (включаючи летальні випадки) (див. розділ «Побічні реакції»), при цьому більшість випадків виникали протягом перших тижнів від початку лікування, але могли виникати і пізніше.
Ниркова недостатність. Пацієнти з тяжкою нирковою недостатністю (кліренс креатиніну
Остеонекроз щелепи. Остеонекроз щелепи (ОНЩ) виникав у пацієнтів, які отримували препарат Іксджева. В клінічних дослідженнях частота ОНЩ була вищою при більш тривалому впливі препарату (див. розділ «Побічні реакції»).
ОНЩ також діагностувався після лікування препаратом Іксджева, при цьому більшість випадків виникали протягом 5 місяців після введення останньої дози.
Відомі фактори ризику для ОНЩ включають інвазивні стоматологічні процедури (наприклад видалення зубів, встановлення зубних імплантатів, хірургічні втручання в ротовій порожнині), погану гігієну ротової порожнини або інші існуючі стоматологічні захворювання, інфекції, літній вік, супутнє лікування (наприклад хіміотерапія, застосування кортикостероїдів, інгібіторів ангіогенезу, променева терапія голови та шиї), тютюнопаління та попереднє лікування біфосфонатами. Для пацієнтів з факторами ризику ОНЩ необхідно провести індивідуальну оцінку співвідношення користь-ризик перед початком терапії препаратом Іксджева.
Рекомендується стоматологічний огляд з відповідним профілактичним стоматологічним лікуванням перед початком застосування препарату Іксджева. Препарат Іксджева не можна починати застосовувати пацієнтам з активними захворюваннями зубів або щелеп, які вимагають хірургічного втручання, або пацієнтам, які ще не видужали після хірургічного втручання в ротовій порожнині.
Всі пацієнти повинні підтримувати достатню гігієну ротової порожнини, проходити періодичні стоматологічні огляди і негайно повідомляти про будь-які симптоми з боку ротової порожнини, такі як рухливість зубів, біль або набряк під час лікування препаратом Іксджева. Пацієнти повинні ознайомитися з Інструкцією для застосування лікарського засобу для отримання інформації щодо симптомів ОНЩ.
Під час лікування пацієнти по можливості повинні уникати інвазивних стоматологічних процедур. У пацієнтів, у яких розвинувся ОНЩ під час лікування препаратом Іксджева, стоматологічне хірургічне втручання може погіршити захворювання. План ведення окремих пацієнтів з ОНЩ повинен бути розроблений в тісній співпраці лікуючим лікарем та стоматологом або щелепно-лицьовим хірургом, який має досвід лікування ОНЩ. Тимчасове припинення лікування необхідно розглядати до моменту завершення хвороби і, у разі можливості, зменшувати провокуючі фактори.
Атипові переломи стегна. Про атипові переломи стегна повідомлялося у пацієнтів, які отримували препарат Іксджева (див. розділ «Побічні реакції»). Атипові переломи стегна можуть виникати при незначній травмі або за її відсутності в субтрохантерній або діафізарній ділянці стегна. Специфічні результати рентгенологічного дослідження характеризують ці явища. Також про атипові переломи стегна повідомлялося у пацієнтів з певними супутніми станами (такими як дефіцит вітаміну D, ревматоїдний артрит, гіпофосфатазія) та при застосуванні певних фармацевтичних засобів (наприклад біфосфонатів, глюкокортикоїдів, інгібіторів протонної помпи). Ці явища також виникали без антирезорбтивної терапії. Аналогічні переломи, про які повідомлялося у зв’язку з прийомом біфосфонатів, часто є білатеральними; таким чином, необхідно обстежувати протилежне стегно у пацієнтів, які отримують деносумаб, з підтвердженим переломом тіла стегнової кістки. Потрібно розглянути відміну препарату Іксджева для пацієнтів з підозрою на атиповий перелом стегна під час оцінки пацієнта на основі індивідуального співвідношення користь/ризик. Під час лікування препаратом Іксджева пацієнтам необхідно рекомендувати повідомляти про новий або незвичний біль в стегні, кульшовому суглобі або паховій ділянці. Пацієнти з такими симптомами повинні перевірятися на наявність неповного перелому стегна.
Інші патології. Пацієнти, які отримують препарат Іксджева, не повинні одночасно застосовувати інші лікарські засоби, які містять деносумаб (у зв’язку з остеопорозом).
Пацієнти, які отримують препарат Іксджева, не повинні одночасно застосовувати біфосфонати.
Злоякісність гігантоклітинної пухлини або прогресування метастазуванням виникає нечасто і є відомим ризиком у пацієнтів з гігантоклітинною пухлиною кісток. Необхідно проводити контроль пацієнтів на наявність рентгенологічних ознак злоякісності, нових ділянок просвітлення або остеолізу. Доступні клінічні дані не вказують на підвищений ризик злоякісності у пацієнтів з гігантоклітинною пухлиною кісток, які отримують препарат Іксджева.
Застереження щодо допоміжних речовин. Пацієнти з рідкісними спадковими проблемами, пов’язаними з непереносимістю фруктози, не повинні застосовувати препарат Іксджева.
Гіперкальціємія після зупинки застосування у пацієнтів з стковою системою, що росте. повідомлялося про клінічно суттєву гіперкальціємію у пацієнтів, що виникала черезпроміжок часу від тижнів до місяців після зупинки застосування, вказані пацієнти на час початку лікування препаратом Іксджева мали кісткову систему, що росте. Пацієнтів потрібно контролювати за симптомами та ознаками гіперкальціємії, а також проводити відповідне лікування.
Застосування у період вагітності та годування груддю.
Вагітність. Відсутні достатні дані щодо застосування препарату Іксджева у вагітних жінок. Репродуктивна токсичність була показана в дослідженні на яванських макаках, які отримували деносумаб під час вагітності, при цьому концентрація AUC була в 12 разів вищою, ніж доза для людини (див. підрозділ «Дані доклінічних досліджень з безпеки»).
Препарат Іксджева не рекомендується для застосовування вагітним та жінкам репродуктивного віку, які не користуються методами контрацепції. Жінкам слід рекомендувати уникати вагітності в процесі лікування препаратом Іксджева і щонайменше протягом 5 місяців після цього. Будь-які ефекти препарату Іксджева найімовірніше будуть сильнішими під час другого та третього триместру вагітності, оскільки моноклональні антитіла проходять через плаценту вільніше з розвитком вагітності, при цьому найбільша кількість проходить під час третього триместру.
Грудне вигодовування. Невідомо, чи виводиться деносумаб з грудним молоком людини. Дослідження на мишах з нокаутованим геном показали, що відсутність RANKL під час вагітності може впливати на дозрівання молочних залоз, призводячи до порушеної лактації після пологів (див. підрозділ «Дані доклінічних досліджень з безпеки»). Необхідно прийняти рішення про відмову від грудного вигодовування або відмову від препарату Іксджева, враховуючи користь грудного вигодовування для новонародженого/дитини, яка знаходиться на грудному вигодовуванні, та користь лікування препаратом Іксджева для жінки.
Репродуктивна функція. Дані щодо впливу деносумабу на репродуктивну функцію у людини відсутні. Дослідження на тваринах не показали прямих або непрямих шкідливих впливів на репродуктивну функцію (див. підрозділ «Дані доклінічних досліджень з безпеки»).
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами
Препарат Іксджева не має впливу або має незначний вплив на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами.
Спосіб застосування та дози
Необхідне щоденне додавання щонайменше 500 мг кальцію та 400 МО вітаміну D, за винятком випадків гіперкальціємії (див. розділ «Особливості застосування»).
Метастази солідних пухлин в кістки. Рекомендована доза препарату Іксджева для попередження кісткових подій становить 120 мг, яку вводять у вигляді підшкірної ін’єкції один раз кожні 4 тижні в ділянку стегна, черевної стінки або плеча.
Гігантоклітинна пухлина кісток. Рекомендована доза препарату Іксджева для лікування гігантоклітинної пухлини кісток становить 120 мг, яку вводять у вигляді підшкірної ін’єкції один раз кожні 4 тижні в ділянку стегна, черевної стінки або плеча, з додатковими дозами по 120 мг на 8 та 15 дні лікування.
Пацієнти в дослідженні фази ІІ, яким була проведена повна резекція гігантоклітинної пухлини кісток, отримували додаткове лікування протягом 6 місяців після операції згідно з протоколом дослідження.
Необхідно проводити оцінку пацієнтів з гігантоклітинною пухлиною кісток на регулярній основі, щоб визначити, чи продовжують вони отримувати користь від лікування. У пацієнтів із захворюванням, яке контролюється препаратом Іксджева, ефект від переривання або тимчасового припинення лікування не оцінювався, проте обмежені дані для цих пацієнтів не вказують на ефект рикошету після тимчасового припинення лікування.
Пацієнти з нирковою недостатністю. У пацієнтів з нирковою недостатністю немає необхідності в корекції дози (див. підрозділ «Фармакокінетика»). Досвід застосування пацієнтам на діалізі або пацієнтам з нирковою недостатністю тяжкого ступеня (кліренс креатиніну
Пацієнти з печінковою недостатністю. Безпека та ефективність деносумабу не досліджувалися у пацієнтів з печінковою недостатністю (див. підрозділ «Фармакокінетика»).
Пацієнти літнього віку (вік ≥65 років). Немає необхідності в корекції дози для пацієнтів літнього віку (див. підрозділ «Фармакокінетика»).
Спосіб застосування. Для підшкірного введення. Препарат Іксджева слід застосовувати під наглядом лікаря.
Перед введенням препарату Іксджева розчин необхідно візуально перевірити. Розчин може містити незначну кількість прозорих або білих білковоподібних частинок. Не вводити розчин, якщо він помутнів або змінив колір. Не струшувати. Щоб уникнути дискомфорту в місці введення, флакон сід нагріти до кімнатної температури (до 25 °C). Препарат вводиться повільно. Вводити весь вміст флакона. Для введення деносумабу рекомендується голка калібру 27. Не вводити голку у флакон повторно.
Будь-який невикористаний лікарський засіб або відходи необхідно утилізувати у відповідності до місцевих вимог.
Діти
Лікування підлітків з дозрілою кістковою системою, які мають гігантоклітинну пухлину кісток, що не може бути видалена або якщо хірургічна резекція, найімовірніше, призведе до тяжких наслідків: доза аналогічна дозі для дорослих.
Препарат Іксджева не рекомендується для застосування дітям (вік
Безпека та ефективність препарату Іксджева не оцінювалися у дітей (вік
Пригнічення ліганду RANK/RANK (RANKL) (ліганд рецептора-активатора нуклеарного фактора каппа В) в дослідженнях на тваринах поєднувалося з пригніченням росту кісток і відсутністю прорізування зубів, і ці зміни були частково оборотними після припинення пригнічення RANKL (див. підрозділ «Дані доклінічних досліджень з безпеки»).
Передозування
Досвід передозування в клінічних дослідженнях відсутній. Препарат Ікджева вводився в клінічних дослідженнях в дозах до 180 мг кожні 4 тижні та 120 мг кожні 3 тижні.
Побічні реакції
Резюме профілю безпеки.
Безпека препарату Іксджева оцінювалася у:
· 5931 пацієнта з пізніми стадіями злоякісних пухлин із залученням кісток, дані про яких були отримані з клінічних досліджень з активним контролем, які вивчали ефективність та безпеку препарату Іксджева у порівнянні з золедроновою кислотою для попередження виникнення кісткових подій.
· 523 пацієнтів з гігантоклітинною пухлиною кісток в клінічних дослідженнях в одній групі, які визначали ефективність та безпеку препарату Іксджева.
Побічні реакції, визначені в цих клінічних дослідженнях та в досвіді післяреєстраційного застосування, представлені в таблиці 3.
Класифікації побічних реакцій, про які повідомлялося в трьох клінічних дослідженнях фази ІІІ та двох клінічних дослідженнях фази ІІ (див. таблицю 3): дуже часто (≥1/10), часто (≥1/100 -
Таблиця 3. Побічні реакції, про які повідомлялося у пацієнтів з пізніми стадіями злоякісних пухлин, які уражають кістки
|
Клас системи органів за MedDRA |
Категорія частоти виникнення |
Побічні реакції |
|
Порушення з боку імунної системи |
Рідко |
Підвищена чутливість до препарату1 |
|
Рідко |
Анафілактична реакція1 |
|
|
Порушення з боку метаболізму та харчування |
Часто |
Гіпокальціємія1,2 |
|
Часто |
Гіпофосфатемія |
|
|
Рідко |
Гіперкальціємія3 |
|
|
Порушення з боку дихальної системи, органів грудної клітки та середостіння |
Дуже часто |
Диспное |
|
Порушення з боку шлунково-кишкового тракту |
Дуже часто |
Діарея |
|
Часто |
Видалення зубів |
|
|
Порушення з боку шкіри та підшкірних тканин |
Часто |
Гіпергідроз |
|
Порушення з боку скелетно-м’язової та сполучної тканини |
Дуже часто |
Скелетно-м’язовий біль1 |
|
Часто |
Остеонекроз щелепи1 |
|
|
Рідко |
Атиповий перелом стегна1 |
1 Див. підрозділ «Опис окремих побічних реакцій».
2 Див. підрозділ «Інші особливі групи пацієнтів».
3 Див. підрозділ «Гіперкальціємія після зупинки застосування у пацієнтів з кістковою системою, що росте» розділу «Особливості застосування».
Опис окремих побічних реакцій
Гіпокальціємія. В трьох клінічних дослідженнях фази ІІІ з активним контролем за участю пацієнтів з пізніми стадіями злоякісних пухлин з ураженням кісток про гіпокальціємію повідомлялося у 9,6% пацієнтів, які отримували препарат Іксджева, та у 5,0% пацієнтів, які отримували золедронову кислоту. Зниження 3 ступеня рівнів сироваткового кальцію виникало у 2,5% пацієнтів, які отримували препарат Іксджева, та у 1,2% пацієнтів, які отримували золедронову кислоту. Зниження 4 ступеня рівнів сироваткового кальцію виникало у 0,6% пацієнтів, які отримували препарат Іксджева, та у 0,2% пацієнтів, які отримували золедронову кислоту (див. розділ «Особливості застосування»).
В двох клінічних дослідженнях фази ІІ з однією групою серед пацієнтів з гігантоклітинною пухлиною кісток про гіпокальціємію повідомлялося у 5,7% пацієнтів. Жодна з побічних реакцій не вважалася серйозною.
В період післяреєстраційного застосування повідомлялося про тяжку симптоматичну гіпокальціємію (включаючи летальні випадки), при цьому більшість випадків виникали в перші тижні після початку лікування. Приклади клінічних проявів тяжкої симптоматичної гіпокальціємії включали пролонгацію інтервалу QT, тетанію, судоми та порушення психічного стану (включаючи кому) (див. розділ «Особливості застосування»). Симптоми гіпокальціємії в клінічних дослідженнях включали парестезію та ригідність м’язів, м’язові посмикування, спазми та м’язові судоми.
Остеонекроз щелепи (ОНЩ). Пацієнти з ОНЩ або остеомієлітом щелепи в анамнезі, активними захворюваннями зубів або щелеп, які вимагають хірургічного втручання, ранами, після стоматологічного втручання/втручання в ротовій порожнині, які не зажили, або пацієнти, з будь-якими запланованими інвазивними стоматологічними втручаннями виключалися з клінічних досліджень.
В первинних фазах лікування трьох активно контрольованих клінічних досліджень фази ІIІ серед пацієнтів з пізньою стадією злоякісних пухлин з ураженням кісток ОНЩ був підтверджений у 1,8% пацієнтів, які отримували препарат Іксджева (середній вплив 12,0 місяців; діапазон 0,1 – 40,5), та у 1,3% пацієнтів, які отримували золедронову кислоту. Клінічні характеристики цих випадків були аналогічними у групах лікування. Серед пацієнтів з підтвердженим ОНЩ у більшості (81% в обох групах лікування) в анамнезі було видалення зубів, погана гігієна ротової порожнини та/або встановлення зубних протезів. До того ж, більшість пацієнтів отримували або вже пройшли хіміотерапію. Дослідження серед пацієнтів з раком молочної залози або простати включали розширену фазу лікування препаратом Іксджева (середній загальний вплив 14,9 місяця; діапазон 0,1 – 67,2). ОНЩ був підтверджений у 6,9% пацієнтів з раком молочної залози або простати під час розширеної фази лікування. Урівноважена частота виникнення для показника пацієнт-рік підтверджених випадків ОНЩ склала 1,1% під час першого року лікування, 3,7% під час другого року та 4,6% у подальші роки. Середній час до виникнення ОНЩ склав 20,6 місяців (діапазон: 4-53).
В двох клінічних дослідженнях фази ІІ з однією групою пацієнтів з гігантоклітинною пухлиною кісток, ОНЩ виник у 2,3% (12 з 523) пацієнтів, які отримували препарат Іксджева (середній загальний вплив 20,3 місяця; діапазон 0-83,4). Урівноважена частота виникнення для показника пацієнт-рік випадків ОНЩ склала 0,2% протягом першого року лікування та 1,7% протягом другого року. Середній час до виникнення ОНЩ склав 19,4 місяця (діапазон 11-40). За тривалістю впливу існує недостатньо даних для оцінки ризику ОНЩ через 2 роки у пацієнтів з гігантоклітинною пухлиною кісток.
У фазі ІІІ плацебо контрольованого клінічного дослідження з подовженням фази лікування для оцінки застосування препарату Іксджева для попередження метастазів у кістки у пацієнтів з неметастатичним раком передміхурової залози (пацієнти, для яких препарат Іксджева не показаний для застосування), з тривалою експозицією протягом до 7 років лікування, розрахована частота пацієнто-років підтвердженого ОНЩ становила 1,1 % протягом першого року лікування, 3,0 % - протягом другого року та 7,1 % - у наступні роки.
Реакції підвищеної чутливості, пов’язані з прийомом препарату. В умовах післяреєстраційного застосування у пацієнтів, які отримували препарат Іксджева, повідомлялося про явища підвищеної чутливості, включаючи рідкісні явища анафілактичних реакцій.
Атипові переломи стегна. В програмі клінічного дослідження у пацієнтів, які отримували деносумаб, були рідкісні повідомлення про атипові переломи стегна (див. розділ «Особливості застосування»).
Скелетно-м’язовий біль. В умовах післяреєстраційного застосування про скелетно-м’язовий біль, включаючи тяжкі випадки, повідомлялося у пацієнтів, які отримували препарат Іксджева. В клінічних дослідженнях про скелетно-м’язовий біль дуже часто повідомлялося в групах деносумабу та золедронової кислоти, однак до відміни препарату дослідження це призводило нечасто.
Діти. Препарат Іксджева досліджувався у відкритому дослідженні, що включало 18 підлітків з дозрілою кістковою системою, які мали гігантоклітинну пухлину кісток. На основі цих обмежених даних, профіль побічних реакцій виявився аналогічним профілю для дорослих.
Інші особливі групи пацієнтів.
Ниркова недостатність.
В клінічному дослідженні у пацієнтів без пізньої стадії раку з нирковою недостатністю тяжкого ступеня (кліренс креатиніну
Супутні підйоми рівнів паратиреоїдного гормону також спостерігалися у пацієнтів, які отримували препарат Іксджева і мали ниркову недостатність тяжкого ступеня або були на діалізі. Моніторинг рівнів кальцію та достатнє надходження кальцію та вітаміну D особливо необхідні для пацієнтів з нирковою недостатністю (див. розділ «Особливості застосування»).
Звітування про побічні реакції.
Звітування про побічні реакції після реєстрації лікарського засобу має важливе значення.
Це дозволяє здійснювати безперервний моніторинг співвідношення між користю та ризиком пов’язаним із застосуванням лікарського засобу. Медичним працівникам необхідно повідомляти про будь-які про побічні реакції.
Термін придатності
3 роки.
Умови зберігання
Зберігати в холодильнику при температурі від 2 до 8 °С в оригінальній упаковці для захисту від світла. Не заморожувати. Не струшувати. Зберігати в недоступному для дітей місці. Після вилучення з холодильника зберігати при температурі не вище 25 °С в оригінальній упаковці. Термін придатності після вилучення з холодильника – 30 днів.Упаковка
По 1,7 мл розчину (70 мг/мл) у флаконі, що виготовлений зі скла 1 типу (відповідає вимогам Європейської фармакопеї) із фтор полімерною ламінованою еластомерною пробкою та алюмінієвою обкаткою з захисною пластиковою кришкою.По1 флакону разом з інструкцією про застосування вкладають в картонну коробку.
Категорія відпуску
За рецептом.Виробник
Амджен Мануфекчурінг Лімітед, Пуерто-Ріко, США
/ Amgen Manufacturing Limited, Puerto Rico, USA.
Амджен Європа Б.В, Нідерланди
/ Amgen Europe B.V., The Netherlands.
Місцезнаходження
Стейт Роуд 31, Кілометeр 24.6, Джанкос, Пуерто-Ріко 00777-4060, США.
Мінервум 7061, 4817 ZK, Бреда, Нідерланди.




